기사본문
메이파마, 쿄와기린에 'PI3Kδ저해제' 6.5억弗 기술이전
입력 2020-04-17 09:14 수정 2020-04-17 09:14
바이오스펙테이터 서일 기자

미국 바이오텍 메이파마(Mei Pharma)는 14일(현지시간) 일본의 쿄와기린(Kyowa Kirin)과 B세포 악성종양(B cell malignancies) 치료제 후보물질 ‘ME-401’의 글로벌 라이선스, 개발, 상업화에 대한 기술이전 계약을 체결했다고 밝혔다. 두 회사는 2018년 ME-401의 일본내 개발과 상업화를 위한 계약을 체결한 바 있다.
이번 계약에 따라 메이파마는 쿄와기린으로부터 계약금 1억달러를 현금으로 받고 ME-401의 미국외 지역 개발, 규제, 상업화에 따른 마일스톤으로 최대 5억5250만달러를 추가로 지급받기로 했다. 또한 미국 식품의약국(FDA)이 ME-401을 승인할 경우 메이파마와 쿄와기린은 미국내 개발 비용과 이익을 50대 50으로 나누기로 했다.
ME-401은 1일1회 경구용 PI3Kδ 저해제(inhibitor)로 개발됐다. 메이파마는 ME-401에 대한 안전성, 약동학(pharmacokinetics) 등을 평가한 임상1상(NCT0252138)에서 150mg용량까지 내약성을 확인했다고 밝혔다(doi.org/10.1016/j.clinthera.2018.09.006). 임상종양학회(ASCO)에서 발표한 자료에 따르면 메이는 재발성/불응성 여포성 림프종 환자 50명을 분석한 임상 2상(NCT03768505) 중간결과, ME-401 단독요법에서 전체반응률(objective response rate, ORR) 80%, ‘ME-401+리툭시맙’ 병용요법에서 ORR 83%의 결과를 보였다.
메이파마는 B세포 악성종양 환자 177명을 대상으로 ‘ME-401’ 단독요법과 ME-401에 CD20 항체인 ‘리툭산(Rituxan, rituximab)’ 또는 BTK 저해제인 ‘브루킨사(Brukinsa)’를 병용투여해 효과를 비교 평가하는 임상 1b상(NCT02914938)을 진행 중이다. 또, 일본에서 2019년부터 B세포 악성종양 환자에서 ME-401 단독요법의 효과를 평가하고 있다.
데이비드 우르소(David M. Urso) 메이파마 최고운영책임자(COO)는 “쿄와기린과의 글로벌 파트너십은 ME-401을 광범위하게 개발, 상업화하는 목표를 달성하기 위한 핵심 단계다”고 말했다.
토모히로 스도(Tomohiro Sudo) 쿄와기린 전략제품기획부 임원은 “전세계에서 ME-401의 개발, 상업화에 대한 메이파마와 계약을 확장하게 돼 기쁘다”며 “ME-401은 B세포 악성종양 환자에게 새로운 치료옵션이 될 수 있다고 생각한다”고 말했다.
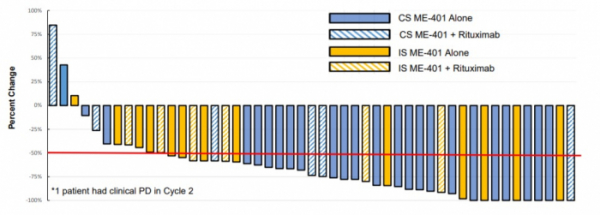
▲ME-401 단독요법과 ME-401+리툭시맙의 전체반응률(ASCO2019 메이파마 발표자료)







