기사본문
ADC 테라퓨틱스, 2.32억불 IPO..”혈액암 치료제 개발”
입력 2020-05-18 07:03 수정 2020-05-18 07:03
바이오스펙테이터 서일 기자

ADC 테라퓨틱스(ADC Therapeutics)는 14일(현지시간) 미국 나스닥시장 기업공개(IPO)를 통해 약 2억3270만달러를 조달했다고 밝혔다. ADC는 주당 19달러로 총 1224만5631주를 공모했다. 나스닥에서 ADC 테라퓨틱스의 주식은 ‘ADCT’로 거래된다.
ADC 테라퓨틱스는 IPO를 통해 공모한 자금으로 미만성 거대B세포림프종(DLBCL)와 호지킨림프종에 대한 항체약물접합체(antibody-drug conjugates, ADC)를 개발할 계획이다. ADC 테라퓨틱스는 PBD(pyrrolobenzodiazepine) 이량체(dimer)를 사용한 ADC 약물을 개발하고 있다. ADC는 PBD 이량체가 암세포내에 들어가 DNA에 비가역적으로 결합해 DNA 복제, 수리(repair) 등을 억제함으로써 세포 독성을 유발해 암세포를 죽이는 기전을 가진다고 설명했다.
먼저, ADC 테라퓨틱스는 DLBCL을 대상으로 CD19 ADC 약물인 ‘론카스툭시맙(loncastuximab tesirine, Lonca, ADCT-402)’의 임상 2상 연구를 진행하고 있다. ADC는 지난해 재발성/불응성 DLBCL을 앓고 있는 145명의 환자를 대상으로 론카스툭시맙 상업화 임상 2상(NCT03589469)의 중간분석(interim analysis) 결과 전체반응률(ORR) 45.5%를 나타냈다. 완전관해(CR)를 보인 환자는 20%, 부분반응(PR)을 보인 환자는 25.5%였다.
ADC는 2020년 하반기 DLBCL에 대한 론카스툭시맙의 생물의약품 허가신청서(biologics license application, BLA)를 미국 식품의약국(FDA)에 제출할 예정이라고 밝혔다.
또, ADC는 DLBCL과 외투세포림프종(mantle cell lymphoma, MCL)을 대상으로 론카스툭시맙과 얀센(Janssen)의 BTK 저해제 ‘임브루비카(Imbruvica, ibrutinib)’ 병용요법 임상 1/2상, 여포성림프종(follicular lymphoma)을 대상으로 론카스툭시맙의 상업화 임상 2상을 진행하고 있다.
다음으로 ADC 테라퓨틱스는 재발성/불응성 호지킨림프종 환자 100명을 대상으로 CD25 ADC 약물인 ‘카미단루맙(camidanlumab tesirine, Cami, ADCT-301)’의 상업화 임상 2상(NCT04052997)을 진행중이다. ADC는 2013년 덴마크의 젠맙(Genmab)과 카미단루맙을 공동개발하기 위한 파트너십을 맺은 바 있다.
ADC는 지난 4월 카미단루맙 임상 2상의 중간분석에서 전체반응률(ORR)을 보인 환자는 66.7%였으며, 완전관해(CR)와 부분반응(PR)을 보인 환자는 각각 16.7%, 50%였다고 밝혔다. ADC는 카미단루맙 임상 2상의 탑라인 결과를 2021년 상반기 발표할 예정이다.
한편, ADC는 급성 림프구성 백혈병(acute lymphoblastic leukemia, ALL)에 대한 CD22 ADC 약물인 ‘ADCT-602’의 임상1/2상을 진행하고 있다. 또, 고형암에 대한 전임상 단계 약물인 KAAG1 ADC 약물 ‘ADCT-901’과, DLK1 ADC 약물 ‘ADCT-701’을 개발 중이다.
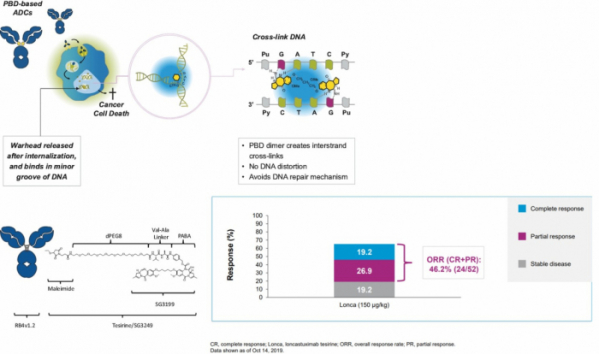
▲ADC-PBD 기전과, 론카스툭시맙 임상 2상 결과(ADC 테라퓨틱스 SEC 자료, ASH 2019 발표자료)







