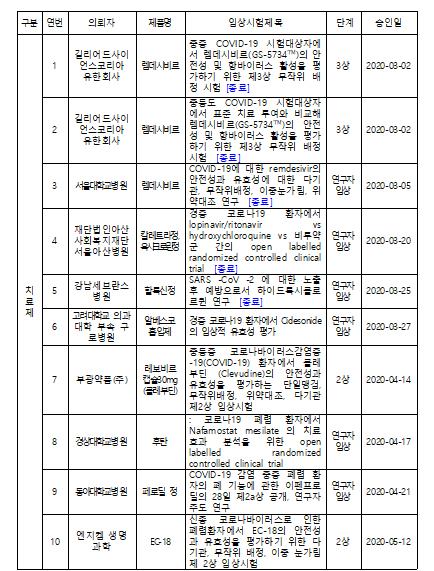
기사본문
국내 코로나19 임상..치료제 10건·백신 2건 진행
입력 2020-07-10 16:58 수정 2020-07-10 22:58
바이오스펙테이터 장종원 기자
국내에서 코로나19 치료제, 백신 개발을 위해 총 12건의 임상이 진행중인 것으로 나타났다.
식품의약품안전처는 10일 국내에서 개발되는 치료제·백신의 임상시험 및 허가·심사 현황에 대한 정보를 공개했다.
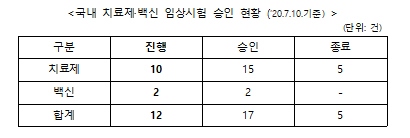
현재 국내에서 코로나19 관련 진행 중인 임상시험은 치료제 10건, 백신 2건이다.
치료제의 경우 총 15건을 승인받았으며 5건은 종료됐다. 렘데시비르(3건)는 계획대로 임상시험이 완료됐으며 옥시크로린정(히드록시클로르퀸)·칼레트라정 비교임상 및 할록신정(히드록시클로르퀸) 임상의 경우, 히드록시클로로퀸의 코로나19 관련 치료적 유익성이 인정되지 않는다는 해외 연구 결과 등에 따라 종료됐다.
최근 새롭게 임상이 승인된 2건은 약물 재창출을 통해 이미 허가된 카모스타트 성분 의약품을 이용해 개발 중인 CG-CAM20(크리스탈지노믹스) 및 DWJ1248정(대웅제약)이다.
카모스타트는 만성 췌장염 및 역류성 식도염 치료를 위해 사용하는 의약품으로, 세포 단계 시험에서 코로나19 바이러스의 활성을 억제했고 바이러스가 감염된 마우스에서 생존율 개선 효과를 나타냈다.
백신은 제넥신과 이노비오가 모두 1/2a상 초기단계를 진행하고 있다.
식약처는 현재 임상시험 계획을 심사 중인 코로나19 치료제·백신은 5개이며 신청을 위해 사전상담이 진행 중인 의약품은 33개가 있다고 설명했다. 심사 중인 5개 제품은 모두 국내 개발 치료제로, 신약 항체치료제가 1개, 약물재창출 치료제가 4개다.
사전상담은 혈장분획치료제 등 치료제 23개 제품, 백신 10개 제품이 진행 중에 있으며, 지역적으로는 국내개발이 27개로 나타났다.
식약처 관계자는 “유럽의약품청(EMA)과 코로나19 진단·예방·치료 의약품에 대한 상호 정보교환 시 비밀을 유지하는 임시 약정을 체결하는 등 국제적인 공조를 확대해 나가겠다”고 말했다.