기사본문
이뮨앱스, 신규 ‘C5 항체’ ”보체 자가면역 신약개발”
입력 2023-05-17 11:05 수정 2023-05-19 18:44
바이오스펙테이터 서윤석 기자

▲김동조 이뮨앱스 대표
이뮨앱스(ImmunAbs)가 C5 억제 효능과 안전성을 개선한 차세대 보체5(complement 5) 항체를 이용해 보체 유래 자가면역질환 치료제 개발에 나섰다.
김동조 이뮨앱스 대표는 “기존 약물보다 표적 선택성이 높아 더 효과적인 C5 활성을 억제한 전임상 결과를 기반으로 현재 리드파이프라인 ‘IM-101’의 미국 임상1상을 진행하고 있다”며 “치료효과를 예상해볼 수 있는 free C5 등 바이오마커 분석도 예정되어 있어, 최종결과가 도출되는 올해말이 변곡점이 될 것으로 판단한다”고 말했다.
지난 2017년 설립된 이뮨앱스는 셀트리온에서 글로벌 기술사업부장을 역임한 김동조 대표와 목암연구소 항체공학팀장을 역임한 김기수 연구소장을 주축으로, 셀트리온에서 비임상연구, 임상운영, 품질관리(QA/QC) 등과 GC에서 제조공정(CMC)을 맡았던 팀장급 인력이 합류해 연구개발을 진행하고 있다. 이뮨앱스는 지난 2021년 시리즈A로 116억원, 지난해 시리즈B로 130억원의 투자금을 유치했다.
이뮨앱스의 리드파이프라인 ‘IM-101’은 자가면역질환의 핵심 신호경로인 보체시스템(complement system) 중 C5를 타깃해 억제하는 항체 치료제다. IM-101은 기존 승인약물인 아스트라제네카/알렉시온(Astrazeneca/Alexion)의 C5 항체 ‘솔리리스(Soliris, eculizumab)’와 ‘울토리미스(Ultorimis, ravulizumab)’와는 다른 부위를 타깃해 억제한다. 이뮨앱스는 현재 미국 임상1상에서 IM-101의 안전성, 내약성 등을 분석하고 있으며, 올해말 최종결과 도출을 예상하고 있다.
이뮨앱스는 전임상 연구에서 기존 C5 항체보다 IM-101의 높은 C5활성 억제효과를 확인한데 더해, 현재까지 진행한 임상에서 특별한 안전성 이슈가 나타나지 않은 점을 긍정적으로 평가했다.
이뮨앱스는 향후 중증근무력증(generalized Myasthenia Gravis, gMG), 시신경척수염(NMOSD) 등을 적응증으로 IM-101을 개발할계획이다.
리드 파이프라인 C5 항체 ‘IM-101’..올해말 미국 1상 최종결과 도출 기대
보체시스템은 미생물, 바이러스, 암세포, 항원 등 외부물질(foreign pathogen)에 의해 활성화하며, 옵소닌화(opsonization)을 통해 항체 면역반응을 돕는다. 옵소닌화는 항체 등이 병원체를 둘러싸 식세포에 의해 용해되기 쉬운 형태로 만드는 현상을 의미한다.
보체시스템은 항체에 의해 유도되는 고전경로(classical pathway), 항체 비의존적으로 활성화되는 대체경로(Alternative pathway) 등으로 구분된다. 보체시스템의 신호경로 활성화는 C1q/r/s(C1qrs)로 이뤄진 C1복합체(C1 compelx)로부터 시작돼, C1복합체→C2, C4 활성화→C3활성화→C5 활성화를 거쳐 외부물질을 제거한다. 보체활성화 과정에서 생성된 C3b, C5b 등의 단백질은 세포와 결합해 막공격복합체(membrane attack complex, MAC)를 형성해 세포에 구멍을 내 제거하는데, 보체가 활성화되면 자신의 세포를 공격하는 발작성 야간혈색소뇨증(PNH), 용혈성 요독증후군(HUS), 중증근무력증(gMG), 시신경척수염 등 다양한 자가면역질환이 발생한다. 이들 질병의 발병에는 고전경로와 대체경로가 하나 또는 모두 관련이 있는 것으로 알려져 있다.
이뮨앱스의 연구에 따르면 리드 파이프라인인 IM-101은 고전경로와 대체경로의 C5 활성을 경쟁약물보다 효과적으로 억제했다. 이뮨앱스는 정상인으로부터 얻은 혈액을 이용해 체내의 생리학적 환경을 유사하게 모방한 조건(25% serum)에서 IM-101과 경쟁약물인 솔리리스, 울토리미스 등을 0.7~375ug/mL 용량으로 처리해 C5 활성을 분석했다. 그 결과 고전경로의 C5 활성은 솔리리스, 울토리미스 투여군에서 최대 60~70% 억제된 반면, IM-101 투여군은 100%에 근접하게 억제했다. 대체경로의 C5 활성은 IM-101에서 90%이상 억제된 반면 솔리리스와 울토리미스는 70~80% 억제한 결과를 보였다.
실제로 솔리리스는 장기적으로 일부 PNH 환자에서 C5 활성을 완전히 억제하지 못해 추가 치료가 필요했다. 솔리리스로 치료받은 환자를 평균 5.59년간 추적한 리얼월드(realworld) 연구결과, 환자 38%(29/76)는 수혈이 필요했으며, 추적관찰동안 특정시점에는 돌발증상(breakthrough symptom), 돌발용혈(breakthrough hemolysis), 수혈의존성의 사례가 각각 63%, 43%, 63%의 환자에서 발생했다. PNH의 증상과 직접적인 상관관계에 있는 정상 혈소판 수치와 세포의 손상여부 평가 바이오마커인 LDH(Lactate Dehydrogenase) 수치는 기준선 1540.8U/L에서 303.6U/L로 평균 80.3% 감소했다(doi.org/10.1111/ejh.13970). LDH의 정상범위는 140~280U/L다.
또다른 연구에서는 솔리리스로 치료받은 환자로부터 얻은 혈액(serum 25%)에서 약 80% 수준의 C5 활성억제 효과를 보였다(doi.org/10.1182/blood-2016-08-732800). 다른 C5 억제제인 코버신(coversin)은 최대 60% 수준의 C5 활성 억제효과를 나타냈으며, 솔리리스와 코버신을 병용투여 시에는 C5 활성을 100% 근접하게 억제했다. 코버신은 솔리리스와 C5에 결합하는 부위가 다른 17kDa 크기의 단백질이다.
김 대표는 “기존 약물에서 불충분한 C5 활성 억제는 정상범위 이상의 LDH 수치로 이어져 일상생활에 여전히 어려움을 주는 한계가 있었다”며 “IM-101의 경쟁약물 대비 효과적인 고전경로 및 대체경로의 C5 활성 억제는 자가면역질환 환자들에게 더 높은 치료효과를 기대할 수 있는 포인트”라고 말했다.
이뮨앱스는 미국에서 48명의 건강한 임상참여자를 8명씩 6개 코호트로 나눠 임상1상을 진행하고 있다. 각 코호트는 200mg, 400mg, 600mg, 800mg 1600mg, 3200mg용량의 IM101 투여군(6명)과 위약군 2명으로 구성된다. 이뮨앱스는 현재 400mg 용량의 코호트2까지 투여를 완료했으며, 아직까지 안전성 이슈가 발생하지 않은 점이 고무적이라는 설명이다.
이뮨앱스는 올해말 최종결과를 도출할 수 있을 것으로 기대하고 있으며, 최종분석에서 약물의 치료효과를 대변하는 약력학(PD)적 마커인 free C5 수치를 분석하고 결과에 따라 후속임상을 진행할 계획이다.
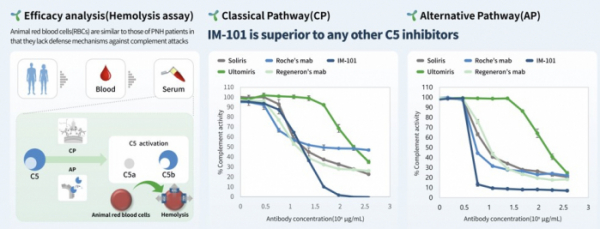
▲IM-101의 C5활성 억제효능(이뮨앱스)
첫 적응증 중증근무력증..”전임상서 경쟁약물 대비 효과적 C5 활성 억제”
이뮨앱스는 임상1상 결과를 기반으로 중증근무력증(gMG)를 첫 적응증으로 개발할 계획이다. 중증근무력증은 신경근육접합(neuromuscular junction) 이상으로 인해 발병하는 대표적인 질환으로 항체에 의해 발병하는 자가면역질환이다. 초기에는 눈꺼풀처짐(안검하수), 복시 등의 증상이 나타나며 얼굴표정 변화, 서있기, 걷기, 피곤함 등으로 기본적인 운동능력 저하 및 일상생활이 어려워지며, 호흡곤란으로 인해 사망하기도 한다.
중증근무력증은 신경과 근육이 연결되는 신경근육접합부의 근육표면에 발현하는 아세틸콜린 수용체에 대한 자가항체가 형성돼 신경전달물질의 결합을 방해해 발병하는 기전으로, 진단시점에서는 아세틸콜린분해효소 억제제를 사용해 증상을 완화하고 있다. 이외에도 솔리리스, 울토리미스와 아젠엑스(Argenx)의 FcRN(Neonatal Fc receptor) 항체 절편 ‘비브가르트(Vyvgart, efgartigimod)’ 등이 치료제로 사용된다.
이뮨앱스는 중증근무력증(gMG) 환자 40명으로부터 얻은 혈액샘플을 이용해 IM-101과 기존 약물 2종 C5-1과 C5-2의 C5 활성을 분석했다. 그 결과 IM-101은 고전경로와 대체경로의 C5 활성을 경쟁약물과 비교해 유의미하게 억제했다(P<0.0001). IM-101 투여군의 고전경로 C5 활성은 -3.85%, C5-1, C5-2 투여군은 각각 23.46%, 46.57% 이었다. 대체경로의 C5 활성은 IM-101 투여군에서 17.45%, C5-1과 C5-2 투여군은 각각 39.55%, 44.48%을 보였다.
이뮨앱스는 시신경척수염(neuromyelitis optica spectrum disorder, NMOSD)을 IM-101의 또다른 적응증으로 개발할 계획이다. NMOSD는 시신경의 아쿠아포린-4가 억제돼 시신경이 망가져 실명에 이르는 병으로 보체 고전경로인 C1qrs에 의해 시신경 수초가 디미엘리네이팅(demyelinating)되면서 발병하는 것으로 알려져 있다.
이뮨앱스는 NMOSD 환자 18명의 혈액을 이용해 IM-101과 기존 약물 2종 C5-1과 C5-2를 비교분석했다. 그 결과 고전경로 C5 활성은 IM-101 투여군 -3.63%, C5-1과 C5-2 투여군은 각각 28.05%, 57.18%로 나타났다. 대체경로의 C5 활성은 IM-101투여군 18%, C5-1과 C5-2 투여군은 각각 39.84%, 45.38%로 나타났다.
김 대표는 “NMOSD 환자의 약 10%는 기존 약물에 반응하지 않으며, 면역억제 관련 부작용이 있어 다른 치료옵션이 필요한 상황”이라고 말했다.
이외에도 이뮨앱스는 당뇨망막병증(diabetic retinopathy) 후보물질 ‘IM-201’, 비만 치료제 후보물질 ‘IM-401’ 등도 개발을 계획하고 있다. 당뇨망막병증은 당뇨합병증 중 하나로 눈의 모세혈관이 터지고 생성되는 것이 반복되면서 나타난 질환으로 건강한 혈관을 형성하게 만드는 기전의 약물이다. 비만 치료제 후보물질은 근육을 늘려 기초대사량을 높이는 기전으로 후보물질 도출단계에 있다.
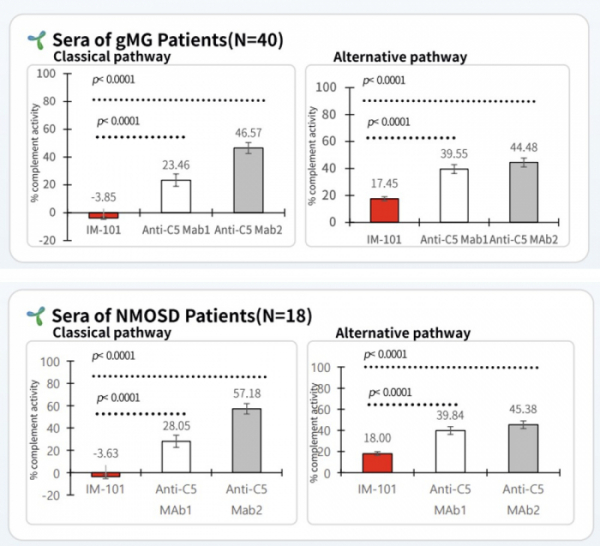
▲IM-101의 중증근무력증 및 시신경척수염 환자 혈액서 C5 억제효능(이뮨앱스)
글로벌 C5 저해제 개발현황은?
C5 저해제 분야는 아스트라제네카/알렉시온(AZ/Allexion)의 C5 항체 솔리리스와 울토리미스가 시장을 선점한 가운데, 후속 약물들이 경쟁하고 있다. 아스트라제네카는 지난 2020년 알렉시온을 390억달러에 인수하는 메가딜을 체결하며 솔리리스와 울토리미스를 포함해 다양한 희귀질환 파이프라인을 확보했다. 솔리리스와 울토리미스의 지난해 매출은 각각 37억6200만달러, 19억6500만달러를 기록했다. 솔리리스와 울토리미스는 각각 2주 및 8주간격으로 정맥투여(IV)하는 약물이다.
로슈(Roche)는 지난 2월 C5 항체 ‘크로발리맙(crovalimab)’을 솔리리스와 직접비교한 PNH 임상3상(NCT04434092)에서 수혈회피와 용혈증상조절에서 비열등성을 보였다. 크로발리맙은 솔리리스와 울토리미스와 C5 결합부위가 다르며 4주간격으로 피하투여(SC)하는 방식으로 편의성을 개선했다.
UCB는 C5 타깃 펩타이드(peptide) ‘질루코플란(zilucoplan)’의 중증근무력증(gMG) 임상3상에서 근무력증 증상 및 일상생활 능력 지표 MG-ADL(Myasthenia Gravis-Activities of Daily Living) 점수를 유의미하게 개선하며 1차종결점을 충족시켰다. 질루코플란은 매일 피하투여(SC)하는 방식의 약물로, 현재 미국 식품의약국(FDA)에서 신약허가신청(NDA)를 승인받아 허가여부를 검토받고 있다.
UCB는 지난해 라 파마(Ra Pharma)를 21억달러에 인수하며 질루코플란과 피하주사제형의 FcRn 항체 후보물질 ‘로자놀리시주맙(rozanolixizumab)’을 파이프라인에 추가했다. UCB는 올해 1월 FDA로부터 중증근무력증에 대한 로자놀리시주맙의 바이오의약품허가신청(BLA)을 승인받고 우선심사절차 통해 허가여부를 검토받고 있다.
리제네론(Regeneron)은 지난 2월 C5 항체 ‘포젤리맙(pozelimab)’을 FDA로부터 초희귀(ultra rare) 유전성 면역질환 채플병(CHAPLE disease)에 대한 우선심사를 승인받았다. 포젤리맙은 오는 8월 20일까지 FDA에서 승인여부가 결정될 예정으로, 승인받게 되면 채플병에 대한 첫 약물이 된다. 채플병은 보체시스템을 조절하는 CD55가 결핍돼 보체시스템이 과활성화 되면서 발병하는 유전질환으로 전세계적으로 100명 미만의 환자가 있는 것으로 알려져 있다.
리제네론은 앨라일람(Alnylam Pharmaceuticals)과 함께 중증근무력증 및 발작성 야간혈색소뇨증에 대해서 포젤리맙과 C5 RNAi ‘셈디시란(cemdisiran)’ 병용요법 임상3상을 진행 중이다.







