기사본문
바이오시밀러 최다 보유한 '삼성'..퍼스트시밀러만 2종
입력 2017-09-18 06:46 수정 2017-09-18 06:46
바이오스펙테이터 장종원 기자

삼성바이오에피스가 유럽 판매허가를 예고한 항암 항체 바이오시밀러 '온트루잔트(ONTRUZANT, 프로젝트명 : SB3)'는 당장 내년부터 의미있는 매출 달성이 가능한 퍼스트 바이오시밀러라는 점에서 의미가 크다. 삼성바이오에피스는 미국·유럽 등 주요시장에 판매 가능한 가장 많은 바이오시밀러 제품군을 가진 기업이라는 위상도 공고히 했다.
17일 업계에 따르면 삼성바이오에피스는 지난 15일 온트루잔트 허가에 대한 유럽의약품청(EMA: European Medicines Agency) 약물사용자문위원회(CHMP: Committee for Medicinal Products for Human Use)의 ‘긍정 의견(positive opinion)’으로 유럽 시장을 공략할 새로운 제품군 확보가 확실시된다. 앞으로 2~3개월 후면 유럽연합 집행위원회(EC: European Commission)의 판매승인이 이뤄질 전망이다.
이렇게 되면 삼성바이오에피스가 유럽에서 허가받은 바이오시밀러는 베네팔리(엔브렐 바이오시밀러, 2016년 1월), 플릭사비(레미케이드 바이오시밀러, 2016년 5월), 루수두나(란투스 바이오시밀러, 2017년 1월), 임랄디(휴미라 바이오시밀러, 2017년 8월)에 이어 온트루잔트(허셉틴 바이오시밀러)까지 총 5종으로 늘게 된다. 미국에서 허가받은 렌플렉시스(레미케이드 바이오시밀러, 2017년 4월), 루수두나(란투스 바이오시밀러, 2017년 7월 잠정승인) 까지 포함하면 총 7종이다.
제품군에서는 셀트리온(Celtrion, 미국 1종-유럽 2종), 산도스(Sandoz, 미국 1종-유럽 2종), 암젠(Amgen, 미국 1종-유럽 1종) 등을 압도한다.(글로벌 Top 10 의약품의 바이오시밀러 기준) 삼성바이오에피스 관계자는 "온트루잔트가 EC의 최종 판매 승인을 받을 경우 글로벌 Top 10 의약품의 바이오시밀러를 최다 보유한 기업이 될 것"이라면서 "삼성바이오에피스가 개발한 바이오시밀러 제품군이 자가면역질환 치료제에서 항암제 분야로 확대된다는 데에도 의미가 있다"고 강조했다.
특히 온트루잔트는 유럽에서 최초로 허가받은 퍼스트 바이오시밀러다. 삼성바이오에피스의 베네팔리와 셀트리온 램시마에서 보듯 퍼스트 바이오시밀러는 시장을 선점해 매출을 올릴 수 있는 최상의 카드다. 유럽에서 판매중인 베네팔리는 올해 2분기 8870만 달러(약 1000억원)의 매출을 올리면서 전분기 보다(6530만 달러)보다 30% 이상 성장하는 등 승승장구하고 있다. 온트루잔트는 허셉틴의 바이오시밀러를 가장 먼저 승인 받을 것으로 예상했던 마일란(Mylan)/바이오콘(Biocon)이 EMA의 공장 실사에서 문제점이 발견돼 지난 8월 유럽 판매 허가 신청을 철회하면서 퍼스트시밀러 자리를 차지하게 됐다.
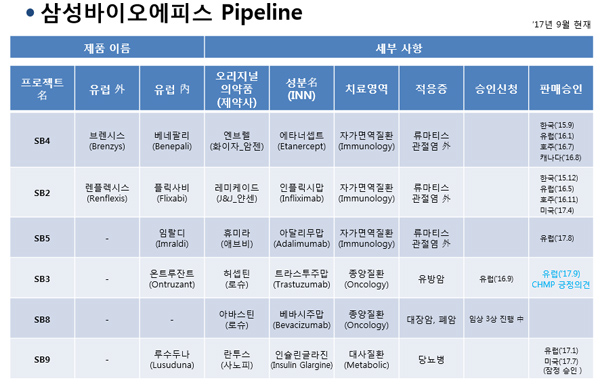
게다가 허셉틴의 유럽 특허는 이미 2014년 만료돼 제품 출시에 걸림돌이 없는데다 허셉틴의 전세계 매출은 7조 8000억원 중 유럽의 비중이 30.3%로 미국(37%)에 비해 크게 뒤지지 않는다는 점도 삼성과 온트루잔트에게는 기회다. 삼성바이오에피스는 현재 의미있는 매출을 기록하는 바이오시밀러는 베네팔리뿐이다. 렌플렉시스는 미국 시장에 갓 출시됐고 임랄디는 특허가 남았으며 플릭사비는 퍼스트시밀러 램시마에 발목이 잡혔다. 온트루잔트는 내년부터 본격 판매돼 삼성바이오에피스의 매출 증가에 도움이 될 전망이다.
삼성바이오에피스 관계자는 "온트루잔트가 EC 최종 판매 승인을 받을 경우 유럽에서 최초로 승인 받는 허셉틴 바이오시밀러가 되는 것이며 비슷한 시기에 허가 신청한 경쟁사들을 제치고 퍼스트 무버(First mover)로서 유럽 시장에서 유리한 위치를 선점할 수 있을 것으로 기대된다"고 강조했다. 후발주자로는 셀트리온(2016년 10월 EMA 허가 신청), 암젠(2017년 3월) 등이 있다.
한편 온트루잔트의 허가단계 진입으로 삼성바이오에피스는 초기 6개 파이프라인 중 대장암·폐암 치료제인 아바스틴(Avastin)만을 임상개발 단계에 남겨두게 됐다. 성장을 지속하기 위한 후속 파이프라인에 대한 고민이 필요한 시점이다.
삼성바이오에피스는 지난 5월 황반변성 치료제 루센티스(Lucentis) 바이오시밀러인 'SB11'의 임상 3상 시험 계획을 미국 임상시험 정보사이트(clinicaltrials)에 등록했다. 이외에도 2020년 이후 특허가 만료되는 다수의 블록버스터 바이오의약품의 세포주 구축 및 전임상 시험을 진행 중인 것으로 알려졌다. 이와 함께 삼성바이오에피스는 지난달 다케다제약과 손잡고 최초로 급성 췌장염 신약(TAK-671) 개발에도 도전한다.