기사본문
[남궁석 교수의 신약연구史] 연재를 시작하며
입력 2017-09-21 14:32 수정 2017-09-21 14:32
남궁석 충북대 교수
바이오테크놀로지가 한국을 먹여살리는 차세대 성장산업이 될 것이라는 이야기를 들은지도 꽤 오랜 시간이 지난 것 같다. 필자의 기억으로는 1980년대 초중반 국내에 ‘유전공학' 붐이 조성되면서부터 나온 이야기로 생각되므로 ‘차세대 성장산업' 으로 바이오테크놀로지가 한국에서 이야기된지도 어언 30여년이 흐른 셈이다. 그러나 한국에서 과연 바이오테크놀로지는 ‘현재' 한국을 먹여살리는 주력 산업인가? 물론 그동안 척박한 여건하에서 한국에서 바이오테크놀로지의 싹을 틔우고자 노력한 산업계 및 학계의 많은 구성원들 덕에 적어도 가시적인 발전을 이루었다는 것은 부인할 수 없다. 그러나 적어도 국내의 중화학공업이나 ICT 산업계의 눈부신 발전에 비교하면 한국의 바이오테크놀로지 산업이 갈 길은 매우 멀다는 것을 부인하기 힘들다.

▲남궁석 충북대학교 교수, 제1회 매드사이언스페스티벌에서 발표하는 모습
그렇다면 바이오테크놀로지가 중화학산업이나 ICT 등의 다른 산업계에 비해서 산업화를 이룩하기가 어려운 근본적인 이유는 무엇일까? 여기에는 여러가지 이유가 있겠지만, 근본적으로 바이오테크놀로지는 기본적으로 원천기술과 지적소유권에 민감하며, 기초연구로부터 산업화에 걸리는 시간이 ICT 등의 다른 산업계에 비해 극히 길다는 것을 생각할 수 있다. 더우기 한국에서는 이러한 원천기술이 창출될 수 있는 기반이 되는 생명의과학 분야의 기초연구의 역사가 일천하다는 것이 결정적인 이유일 것이다. 아마도 한국 내에서 기초의생명과학 연구를 통해서 축적된 지식에 기반하여 산업화까지 이룩한 경험이 축적된다면 상황은 달라지겠지만, 이러한 경험이 절대적으로 부족하다는 것이 한국의 바이오테크놀로지가 아직도 걸음마 단계를 벗어나지 못하는 결정적인 이유일 것이다.
그렇다면 이 과정에서 조금이라도 시행착오를 줄이기 위해서는 지금 현재 시장에서 막대한 수익을 창출하고 있는 소위 ‘블록버스터'(Blockbuster) 약물 혹은 치료기술들의 기반이 되는 지식들이 어떤 방식으로 과거에 창출되었는지 알아보는 것은 현재의 도약기에 접어드는 한국의 바이오산업계 구성원들에게 일종의 이정표와 같은 역할을 할지도 모른다.
본 연재에서는 앞으로 이러한 블록버스터 약물 혹은 치료수단이 도출되기까지 지적인 바탕이 되는 기초 연구의 성과들이 어떤 방식으로 축적되는지를 다루고자 한다. 주목할 것은 이러한 연구의 시발은 때로는 그 종착역으로 생각되는 질병의 치료와는 전혀 관계없는 연구로부터 비롯된 경우도 허다하다. 본 연재에서는 어떻게 '질병 연구와는 얼핏 관계가 없을 것 같아 보이는' 그런 연구들이 결과적으로 어떻게 질병의 이해와 궁극적으로 치료 수단의 발견으로 이어지는 역사를 살펴보고자 한다. 연재의 제일 처음은 아무래도 업계의 가장 많은 사람들이 관심을 가지고 있는 암을 주제로 한다.
암의 원인을 찾는 여정 : 테오도어 보베리(Theodor Boveri) 로부터 시작된 탐구의 역사
사실 암의 주 원인이 여러가지 유전적 변형이 체세포 내의 유전정보를 담고 있는 지놈에 축적되고, 특히 암유전자(Oncogene) 혹은 암 억제 유전자(Tumor Suppressor Gene) 등의 핵심유전자에서의 돌변이의 측적에 의해 정상세포가 암세포로 변질되는 과정이라는 것은 상식이 되었다. 그러나 그 '상식' 은 언제부터 '상식'이었을까? 암이라는 존재가 최초로 파피루스에 기록으로 남겨진 기원전 2500 년 이집트부터 인류는 암이라는 존재를 인식하고 있었으며, 동시에 이 질병이 당시로는 치료법을 찾기 힘든 병이라는 것도 인지하고 있었다 . 그러나 과연 이 질병이 어떤 원인으로 발생하는지에 대해서는 그 이후 19세기 말에 이르기까지 그닥 이해의 진전이 없었다. 현실적으로 멘델의 유전법칙이 1865년에 처음으로 제창되고 그리고 잊혀진 이후 다른 학자들에게 재발견될때까지는 또 한 세대가 지나야 했다는 것을 생각하면, 암의 원인에 대한 설득력이 있는 설명이 나오기를 기대하는 것은 무리였을 것이다.
그러나 현대적인 암의 원인에 근접하는 주장이 최초로 나온 것은 20세기초 멘델 유전학이 재발견된 이후 그리 멀지 않은 시점이었다. 암이 염색체의 이상에 의해서 발생할 수 있다는 것을 처음 주장한 사람은 독일의 생물학자 테오도어 보베리(Theodor Boveri, 1862-1915) 였다.

▲그림 1 : 테오도어 보베리 (Theodor Boveri, 1862-1915)출처 : https://en.wikipedia.org/wiki/Theodor_Boveri#/media/File:Theodor_Boveri_high_res-2.jpg
보베리는 회충(Ascaris megalocephala)이나 성게(Sea urchin) 알을 이용하여 동물의 발생과정을 연구하는 발생생물학자였다. 그는 1887년부터 회충의 알이 감수분열 이후 정자와 수정되고 최초의 세포분열을 하는 과정을 다룬 일련의 논문을 발표하였다. 그는 초기의 세포분열이 어떻게 일어나는지를 현미경으로 면밀히 관찰하였고, 세포분열과정에서 세포가 분열되기 전에 염색체가 두 개의 중심체(Centrosome) 과 결합하여 방추사를 형성한다는 것을 알았다. 체세포분열 과정을 현대적인 공초점 현미경(Confocal microscope) 등으로 관찰한 경험이 있는 분이라면 보베리가 100여년 전에 묘사한 세포분열 과정이 얼마나 정밀한지를 느낄 것이다.
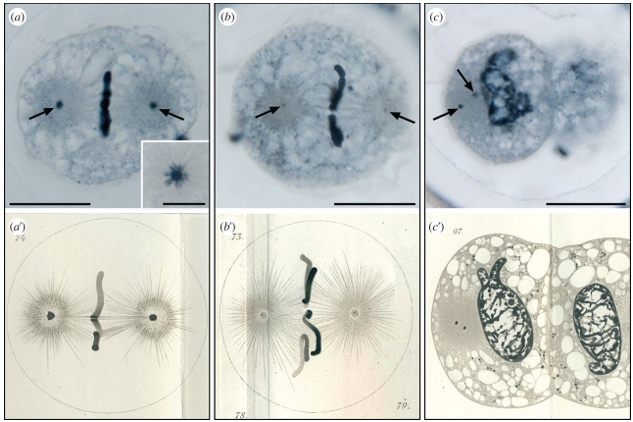
▲그림 2 : 회충 수정란에서 중심체와 세포분열 과정을 관찰한 보베리의 관찰 출처 : http://rstb.royalsocietypublishing.org/content/369/1650/20130469
이후 성게의 알을 모델시스템으로 이용하여 그는 다양한 실험을 수행한다. 만약 수정하기 전의 알의 세포질(Cytoplasm)에서 일정 부피의 세포질 물질을 제거한 후 정자로 수정하는 경우 세포 분열과 이후의 발생은 정상적으로 이루어진다. 즉 세포질의 물질은 일부가 제거되더라도 대치가 가능한 물질임을 알았다. 그러나 핵(Nucleus) 의 경우에는 그렇지 않았다 . 결국 핵에는 후속 세포의 발생을 결정하는 ‘중요한 인자’ 가 있다는 것을 확인하였다. 여기서 더 나아가 보베리는 성게알에 두 개 이상의 정자를 수정한 경우 만약 난자가 2개 이상의 정자에 수정된다면 어떨까? 이 경우에는 두 개 이상의 중심체가 형성되고, 그 이후의 배발생은 정상적으로 이루어지지 않는다는 것을 발견했다.
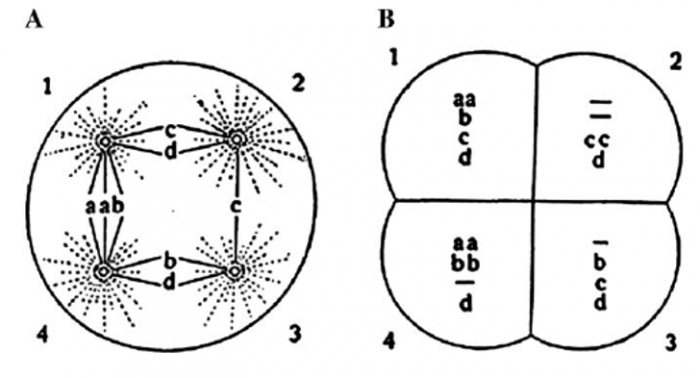
▲그림 3 : 복수의 정자에 의해 수정된 난자는 두 개 이상의 중심체를 가지고 있는 세포에서는 염색체의 균등분리가 이루어지지 않게 되며 이런 딸세포는 비정상적으로 증식한다. 출처 : http://jcs.biologists.org/content/121/Supplement_1/1.full
만약 aa,bb,cc,dd의 염색체를 가지고 있는 생물에서 두개 이상의 중심체가 존재하여 세포분열시에 염색체가 균등하게 분배되지 않는다면 딸세포는 균일하게 a,b,c,d의 염색체를 갖는 것이 아니라 어떤 염색체는 과도하게 존재할 것이고, 일부 염색체는 아예 존재하지 못할 것이다. 즉 그는 정상적인 세포의 성장을 위해서는 모든 염색체가 존재해야 하며, 염색체마다 각각 다른 기능을 수행한다는 것을 깨달았고, , 그의 발견은 당시에 메뚜기를 가지고 연구를 하던 미국의 생물학자 월터 서튼(Walter Sutton, 1877-1916)의 발견과 융합되어, 유전물질이 보베리가 관찰한 ‘염색체’(chromosome)에 담겨져 있고, 염색체가 멘델의 ‘유전형질’ 을 담고 있다는 소위 ‘염색체 이론’(Chromosome Theory)로 발전하였다. 물론 염색체의 유전 정보를 담고 있는 물질의 본질이 DNA 라는 것이 알려지기까지는 그 이후에 반세기에 가까운 세월이 소요되었다는 것 쯤은 굳이 설명하지 않아도 될 것이다.
보베리는 자신의 동물의 발생과정에 대한 연구를 바탕으로 '악성 종양의 기원에 관하여'(Concerning the Origin of Malignant Tumours, Zur Frage der Entstehung maligner Tumoren)라는 제목의 논문을 1914년 발표한다 .
보베리는 해당 논문에서 다음과 같은 가설을 주장한다. 누가 이러한 가설을 주장했는지를 묻는다면 아마 현대의 유명한 암 생물학자의 이름이 나올지도 모르겠지만 이것은 지금으로부터 100년 전에 이미 제시된 가설이다. 괄호 안에는 보베리가 당시 주장한 것에 해당하는 현재의 용어를 기술했다.
1. 암은 비정상적인 염색체 이상에서 유래된다.(Chromosome instability in cancer)
2. 정상적인 세포는 발생 단계에서는 분열을 계속하나 성장하면 분열음 멈춘다. 특정한 외부 자극이 존재할때만 세포의 분열을 가능케하는 ‘저해 기전’ 이 존재할 것이다.(Cell Cycle Checkpoint)
3. 종양을 억제하는 염색체가 존재하고, 이것이 사라질 경우 암의 성장이 유발될 것이다.(Tumor Suppressor Gene)
4. 세포 성장을 촉진하는 암을 유발하는 염색체가 암 발생에서 증폭될 것이다.(Oncogene)
5. 양성 종양(benign tumor) 으로부터 악성 종양(malignant tumor) 으로의 진화는 단계적으로 일어나며 이는 종양을 억제하는 염색체가 사라지고, 암 성장을 유도하는 염색체가 증가함으로써 점진적으로 일어난다.(The two-hits hypothesis)
6. 암은 하나의 세포에서의 염색체 이상으로부터 유래된다.(The clonal orgins of tumours)
7. 암을 구성하는 다양한 세포는 서로 다른 염색체 이상을 가질 수 있다.(genetic mosaicism)
물론 보베리가 사용한 용어들이 현대의 암생물학에서 사용하는 용어와 개념과 완전히 일치하지는 않은 것은 당연하지만 현재 우리가 암의 기전이라고 생각하는 내용 중의 상당수가 이미 100여년 전에 처음 제시되었다는 것은 매우 놀라운 일이다. 참고로 이 논문은 토마스 헌트 모건(Thomas H Morgan)이 1915년에 초파리 돌연변이에의 연구 결과를 바탕으로 “멘델 유전의 기작”(The mechanism of Mendelian heredity)라는 책이 나오기 전에 나왔으므로 아직 ‘유전자’(Gene) 의 개념이 보편화되기 이전에 나왔다는 것을 감안할 필요가 있다. 따라서 염색체 내에 특정한 생물의 기능을 담당하는 독립적인 단위인 유전자(Gene)의 개념은 아직 알려져 있지 않은 상태에서 보베리는 이를 ‘염색체’ 라고 표현했음을 알 수 있다. 이러한 사소한 차이를 제외한다면 보베리는 그 이후 약 100여년간 암 연구에서 벌어질 상황들을 충실히 ‘예언’ 한 셈이다.
물론 보베리의 논문은 당시에 큰 주목을 받지 못하였다. 그 이유에는 여러가지가 있겠지만 ,보베리가 암 연구자가 아닌 성게나 회충 알 등을 이용하여 연구를 하던 생물학자였다는 것도 한가지 이유였을 것이다. 생각해 보면 각종 모델생물을 이용한 연구를 통하여 수많은 질병의 기전들이 규명된 현대에서도 이러한 모델생물을 이용한 연구가 환자의 치료에 무슨 보탬이 되겠느냐는 회의적인 시선을 보내는 사람이 적지 않은 상황에서 암을 직접 연구한 연구자도 아닌, 성게나 회충 알과 같은 하등동물의 실험결과를 근거로 암의 기전을 이야기하는 보베리의 주장이 당시에 큰 반향을 일으키기에는 무리였을지도 모른다.
인간에서 발생한 특정한 종류의 암종에서 보베리가 예언한 것처럼 염색체에 특이적인 변형이 생긴다는 것이 확인되기까지는 보베리의 논문이 나온지 무려 46년이 지난 이었다. 이야기는 1960년, 미국 필라델피아에서 계속된다. (계속)
참고문헌
Boberi, T. Concerning the Origin of Malignant Tumours by Theodor Boveri. Translated and annotated by Henry Harris, J Cell Sci 2008 121:1-84
Malmain, A, Cancer genetics L from Boveri and Mendel to microarray, Nature Rev Cancer, 2001 1:77-82
Hansford, S and Huntsman, D.G, Bovery ast 100:Theodor Boveri and genetic predisposition to cancer, J.Pathol. 2014 234:142-145







