기사본문
[남궁석의 신약연구史]CML과 코난 도일, 필라델피아 염색체
입력 2017-10-11 13:53 수정 2017-10-11 13:53
남궁석 충북대 교수
만성 골수성 백혈병 (Chronic Myeloid Leukemia, CML)
지난회에서는 20세기 초 테오도어 보베리에 의해서 제창된 암의 원인에 대한 가설, 즉 암은 염색체에서의 이상에 의해서 생긴다는 주장에 대해서 살펴보았다. 이전 연재에서도 이야기한 것처럼, 그의 주장은 성게, 회충의 수정란과 같은 하등동물의 발생과정에서 얻은 실험결과에 의해 유추한 것이며 테오도어 보베리는 직접적으로 암을 연구한 연구자도 아닌 관계로 그의 주장은 당장 학계에 큰 파급효과를 주지는 못했다. 실제로 인간의 특정 종류의 암에서 염색체 이상이 생긴다는 것이 확인된 것은 테오도어 보베리의 주장이 처음 발표된 지 거의 46년이 지난, 1960년에 이르러서였다.

▲그림 1: 셜록 홈즈라는 캐릭터를 창조해 내기 전의 코난 도일 (Arthur Conan Doyle) 은 CML의 치료법에 대해서 최초로 연구한 의사였다.
일단 이 이야기를 하기 전에, 최초로 특이적인 염색체 이상이 생기는 혈액암인 만성 골수성 백혈병 (Chronic Myoleoic Leukemia, CML) 에 대해서 잠시 알아보도록 하자. 만성 골수성 백혈병은 조혈모세포가 백혈구를 만드는 과정에서 생기는 혈액암으로써, 혈액중의 백혈구와 혈소판이 급격히 증가되게 되며, 서구에서 발생하는 백혈병 (leukemia) 의 약 15 % 를 차지한다. CML로 추정되는 질병이 최초로 보고된 것은 1841년, 영국의 글래스고우(Glasgow)였으며[1], 이후에 독일과 프랑스에서도 비슷한 증례가 보고된다. CML의 치료법에 대해서는 1882년 영국의 의사 아서 코난 도일 (Arthur Conan Doye, 1859-1930) 이 비소와 식이요법에 의한 치료를 시도하였다는 기록이 남아 있다[2]. (참고로 이 사람은 그 유명한 ‘셜록 홈즈’ 의 작가 코난 도일이다!)
물론 대부분의 암과 마찬가지로 CML 역시 그 원인은 물론 그 확실한 치료법까지도 알려지지 않은 상태였다. 보베리가 주장한 ‘염색체 이상에 의한 암의 발생’ 은 어째서 약 40년이 넘은 이후에서야 증명되었을까?
첫번째는 세포분열 중기 (metaphase) 의 염색체를 염색하여 - 염색체 染色體 라는 단어 자체가 DNA 를 염색하는 시약인 Giemsa 에 의해서 염색되는 세포내의 물질에서 유래된다 - 색체의 갯수를 정확히 세는 기술 자체가 확립되는데 시간이 소요되었다. 가령 인간의 염색체의 갯수는 1921년 48개 (실제로는 46개이지만) 로 알려져 왔으며 이것이 약 30여년간 그렇게 믿어져 왔었다[3]. 인간의 정상적인 세포 유래의 염색체의 갯수도 정확히 세지 못하는 조악한 실험 기술로 암의 염색체 변화를 정확히 알아보기는 힘들었을 것이다. 그리고 오늘날의 상식처럼 종양 조직은 유전적으로 서로 상이한 (heterogenous) 한 세포들의 구성으로 존재하므로 당시의 미약한 기술로는 정상 세포와 각각 다른 변형을 가진 암세포가 섞여있는 상황에서 특정한 염색체 이상이 존재한다는 것을 증명하기는 무리였을 것이다.
필라델피아 염색체 (Philadelphia chromosome)
염색체의 갯수를 정확히 파악하는 소위 세포유전학 (Cytogenetic) 연구는 20세기에 들어 점점 새로운 기술의 발전으로 진보하기 시작했다. 가령 미세소관 (Microtubule) 합성을 억제하는 약물인 콜히친(colchine)을 처리하여 세포주기의 진행을 억제시키고, 저염 용액에서 방추사를 파괴하고 세포를 팽창시키면 좀 더 염색체의 염색을 용이하게 할 수 있다는 것이 1950년대에 이르러 확립되었고, 이러한 기술의 진보에 따라서 1955-1956년에는 인간의 염색체가 기존에 알려진 48개가 아닌 46개라는 것을 알 수 있게 되었다[4].
이와 함께 다운증후군 (Down syndrome) 환자의 경우 21번 염색체가 더 존재한다는 발견이 이어졌다. 이제 인간의 염색체의 이상을 이전보다 정확히 파악할 수 있었던 당시의 연구자들은 서둘러 암에 대한 연구를 수행한다. 1960년 스웨덴의 카롤린스카 연구소의 바이로이터 (Bayereuter) 등은 당시 알려진 몇 가지의 암세포에 대한 염색체 이상을 조사하였으나, 인간의 몇 가지 암세포에서는 별다른 이상을 발견하지 못했다[4]
이런 상황에서 등장한 사람이 1956년 펜실베니아대학 (University of Pennsylvania) 의대에 부임한 젊은 교수인 피터 노웰(Peter Nowell, 1928-2016)이었다. 수련의 시절부터 백혈병에 관심을 가졌던 그는 백혈병 환자 유래의 백혈구에 과연 염색체 이상이 있을지의 여부에 흥미를 가졌고 근처 폭스-체이스 암센터 (Fox Chase Cancer Center)의 대학원생이던 데이비드 헝거포드 (David Hungerford) 와 협력하여 백혈병 유래 세포의 염색체 이상을 살펴보았다. 그들은 처음 급성골수성백혈병 (acute myelogenous leukemia) 유래의 세포를 검사하였으나, 아무런 차이를 찾지 못하였다. 그러나, CML 환자 2명의 세포의 염색체를 살펴보니, 비정상적으로 작은 염색체가 발견되었고 1960년 이 결과가 보고되었다 [6]. 이등해 10명의 CML 환자를 다시 조사해본 결과 이 중 9명에서 이전과 동일하게 ‘비정상적으로 작은 염색체’ 가 또 발견되었으며 [6] 이 결과는 영국의 CML 환자에서도 발견되었다 [7]. 이들이 발견한 ‘작은 염색체’ 는 최초 발견자의 지역으로 호칭한다는 관례에 따라서 노웰과 헝거포드가 근무하던 연구기관이 있던 필라델피아의 이름을 따서 ‘필라델피아 염색체’ (Philadelphia chromosome) 로 알려지게 된다.
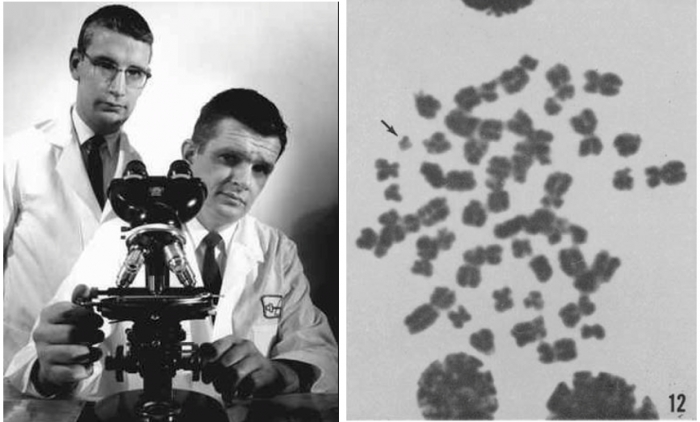
▲그림 2 좌: 필라델피아 염색체의 발견자. 피터 노웰 (좌, Peter C. Nowell, 1928-2016)과 데이비드 헝거포드 (우, David A. Hungerford. 1927-1993), 우: 상염색체에서 제일 작은 22번 염색체보다도 비정상적으로 작은 염색인 필라델피아 염색체 (화살표) (출처: Norwell, P.C. and Hungerford, D.A. Chromosome studies on Normal and Leukemic Human Leukocytes, J. Nat. Cancer Inst. 25:85-109, 1960)
노웰과 헝거포드의 발견 이후 거의 모든 종류의 암에서 비정상적인 염색체 이상이 존재한다는 것이 발견되었다. 즉 염색체의 갯수의 증가, 염색체 구조의 대폭 변형 등의 많은 이상들이 암세포에 존재한다는 것이 확인되었다. 그러나 문제는 이러한 변형은 환자마다, 암 조직마다 제각각이었으며 어떤 특정한 경향성을 보이지 않았다는 것이다. 과연 보베리가 주장한 것처럼 염색체의 변형이 암을 유발하는 결정적인 요인일까? 아니면 이것은 단지 암이 진행되면서 생기는 하나의 결과에 불과할까?
필라델피아 염색체 발견 이후 한참동안 필라델피아 염색체가 유일한 특정한 종류의 암에서 균일하게 발견되는 염색체의 변형이었고, 다른 암에서는 이런 이상이 쉽게 관찰되지 않았으므로 염색체의 특정한 변형이 암을 유발한다는 보베리의 주장은 필라델피아 염색체 발견 이후에도 학계에서 완전히 받아들여지지 않은 셈이었다. 적어도 CML에서 ‘필라델피아의 염색체’ 가 암의 발생과정에 결정적인 역할을 한다는 것이 알려지기까지는 좀 더 오랜 시간이 필요했다.
9번과 22번 염색체의 만남 : 염색체 전좌 (Chromosome Translocation)의 발견

▲그림 3 : 좌:염색법의 개선에 따라 이제 다른 염색체를 다른 밴드패턴으로 구분할 수 있게 되었다. Sumner, A.T. Evans, H.K. Buckland, R.A., Nature New Biology, 1971 우: 필라델피아 염색체가 22번 염색체의 일부분이 잘려 9번 염색체로 붙어 생성된다는 것을 밝혀낸 자넷 로울리 (Janet D. Rowley 1925-2013)
노웰과 헝거포드가 발견한 소위 ‘필라델피아 염색체’ 가 실제로는 22번 염색체의 일부분이 9번의 끝으로 옮겨긴 것이라는 것이 발견되기까지는 최초의 발견이 있은 후 다시 10여년의 시간이 지난 뒤였다. 대개의 새로운 발견은 새로운 테크닉의 개발, 혹은 기존의 테크닉의 개선에 의해 이루어지게 되며, 이 또한 예외가 아니다. 즉 염색체를 염색하는 기술의 개선으로 개별적인 염색체를 서로 다른 밴드 패턴으로 구분할 수 있게 한 기술의 등장으로 이제 크기만을 보고 구분했던 염색체를 좀 더 자세히 구분할 수 있게 되었다[8].
이러한 기술적인 발전을 이용하여 백혈병에서 실제로 염색체 전좌가 일어난다는 것을 규명한 사람은 시카고 대학의 자넷 로울리 (Janet D, Rowley 1925-2013) 였다. 그는 이 새로운 염색테크닉을 이용하여, 이전에 보고된 정체불명의 ‘필라델피아 염색체’ 는 사실 22번 염색체의 q arm (장완)이 결실되었고(22q-), 이것이 9번 염색체의 q arm 에 결합됨이 발견되었다[8]
아마도 이 스토리의 전말을 아시는 분이면, “이제 다음에는 9번 염색체에 있는 무슨 유전자와 22번 염색체에 있는 무슨 유전자가 서로 합쳐지는 이야기가 나오겠구나!”라고 기대할지도 모른다. 그러나 그 이야기를 하기 전에 잠깐 시계를 되돌려 1911년으로 돌아가보자. 그 ‘유전자’ 들이 어떤 맥락에서 발견되었는지를 이해할 필요가 있기 때문이다.
페이튼 라우스와 그의 바이러스
암의 원인을 찾으려고 노력했던 연구자들은 단순히 염색체의 이상만을 암의 원인으로 의심한 것은 아니었다. 이미 18세기 말 영국의 의사 퍼시벌 포트 (Percival Potts) 는 런던의 굴뚝 청소부의 경우 젊은 나이에 암이 발생하는 빈도가 높다는 관찰을 통해 굴뚝 안의 검댕 속에 암을 유발하는 원인이 존재한다는 가설을 제시했다. 그리고 20세기 중반에는 흡연과 폐암과의 밀접한 연관성이 보고되어 환경적인 요인에 의한 암 발생에 대한 연구도 진행되었다.
병원체에 의한 암의 발생설을 믿은 연구자들도 다수 존재했다. 그 중의 한 명이 미국의 젊은 의사인 페이튼 라우스 (Peyton Rous, 1879-1972)였다. 1911년 뉴욕의 록펠러 의학연구소 (후에 록펠러 대학교가 되는) 에 근무하던 라우스는 우연히 매우 큰 종양을 가지고 있던 플리마우스 록 종의 닭을 발견하고, 이 종양을 적출한 후 추출물을 만들고, 여과하여 암세포를 제거하였다. 이를 다른 닭에 주사하여 그는 최초로 암을 유발하고, 다른 생물로 전염시킬 수 있는 매개체인 병원체를 발견하였다. 그가 발견한 것은 나중에 라우스 사코마 바이러스 (Rous Sarcoma Virus, RSV)라고 불리게 되는 레트로바이러스 (Retrovirus) 이다[9]
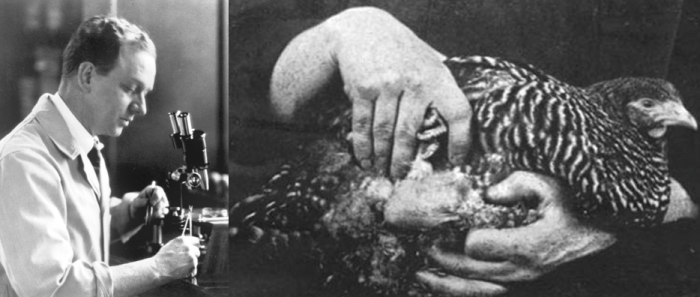
▲그림 4: 페이튼 라우스 (Peyton Rous, 1879-1972) 와 그에게 55년 뒤 노벨상을 안겨준 플리마우스 록 종의 닭. 라우스는 닭에 생긴 종양에서 추출물을 만들고, 이것을 다른 닭에 접종하여 암을 발생할 수 있다는 것을 보여주었다.
그러나 보베리의 ‘암은 염색체 이상에 의해 발생’ 이라는 가설이 입증되거나 받아들여지기까지 매우 오랜 시간이 걸린 것처럼 페이튼 라우스의 ‘암을 유발하는 병원체’ 의 개념 역시 오랫동안 많은 사람의 주목을 끌지 못했다. 라우스의 바이러스는 닭에서는 분명히 암을 유발하는 것이 밝혀졌으나, 사람을 비롯한 포유동물에서는 암을 일으키지 않았고, 포유동물이나 사람에서 암을 일으키는 바이러스는 쉽게 발견되지 않았기 때문이다. 바이러스를 발견한 라우스 역시 그의 바이러스에 대한 연구를 접고 다른 암 관련 연구로 돌아섰다. 그러나 1933년부터 1960년까지, 토끼, 쥐, 고양이, 그리고 유인원에서 암을 유발하는 바이러스가 하나둘씩 발견되었으며, 최초로 인간에서 암을 유발하는 것으로 알려진 바이러스인 엡스타인 바 바이러스 (Epstein-Bar Virus) 가 1964년 발견되었다[10]
그러나 페이튼 라우스의 RSV가 1960년대 중반에 다시 각광받게 된 것은 하워드 테민 (Howard Temin, 1934-1994)이라는 젊은 바이러스학자의 발견이었다. 이들은 닭 배아유래의 fibroblast 배양액에서 RSV를 접종하여 배양하면 감염된 세포에서 세포의 성질이 변하여 암화되어 일종의 콜로니 (Colony)가 형성되는 것을 발견하였다[11]
즉, 세균에 감염하여 세균을 Lysis 시키는 박테리오파지와 마찬가지로 바이러스를 적절히 희석하여 세포에 감염시키면 하나의 바이러스 감염에서 유래된 암화된 콜로니를 얻을 수 있다는 것이다. 즉, 이들은 in vitro 에서 RSV의 감염에 의해서 닭 세포를 암화시킬 수 있다는 것을 증명함과 동시에, 단일한 바이러스 돌연변이주를 순수분리할 수 있다는 것을 보여주었다. 이 발견은 결국 나중에 ‘바이러스에 존재하는 암을 일으키는 유전자’ 의 발견에 핵심이 된다.
테민은 1970년, RNA 바이러스인 RSV가 DNA로 변환되어 세포에 들어가고, 여기서 다시 RNA 바이러스가 복제된다는 그의 가설의 핵심인 역전사효소 (Reverse Transcriptase), 즉 RNA를 주형으로 DNA를 만드는 효소를 최초로 발견한다[12]. 이 역전사효소의 발견은 1970년대 닉슨 행정부에서 대대적으로 벌어진 ‘암과의 전쟁’ (War of Cancer) 의 직접적인 매개체가 된다. 지금의 생각으로는 어이없다고 생각할지 모르지만, 1960년대 말의 이러한 연구들은 대개의 암이 바이러스에 의해서 일어나며, 인간에서 암을 유발하는 바이러스를 찾고, 이의 역전사효소를 저해하는 화합물을 이용하면 모든 암을 치료할 수 있지 않을까 하는 헛된 기대를 갖게 한 주 원인이 되었고, 닉슨 행정부에서 막대한 금액의 연구비를 암에 투자한 계기가 되었다. 여기에 대해서는 차후 연재에서 자세히 설명할 것이다.
어쨌든 페이튼 라우스가 1911년 처음 발견한 그의 바이러스,는 1960년대말에 되서는 암의 이해를 위한 중요한 단서를 제공한 것으로 재평가받게 된다. 1960년대에도 생존하고 있었던 페이튼 라우스는 세상을 떠나기 4년 전인 1966년 RSV의 발견에 대한 공로로 87세의 나이로 노벨 생리학상 수상한다. 즉, 그가 RSV를 발견한 이후 그의 업적이 노벨상으로 인정받을때까지 그는 무려 55년을 기다려야 했다 (역시 노벨상을 타기 위해서는 오래 살아야 한다!). 그는 노벨상 수상 강연에서 암은 유전적 이상에 의해서 생기는 것이 아닌 그가 발견한 RSV와 같은 감염원에 의해서 생긴다는 그의 오랜 소신을 역설했다. 물론 대개의 암의 경우 그의 주장이 맞지 않는다는 것은 오늘의 우리는 잘 알고 있지만, 이것이 밝혀진 것은 그가 몇년 후인 1970년 91세를 일기로 작고한 다음이었다. 역설적인 일이지만 라우스의 바이러스와 이를 이용하여 밝혀진 연구는 라우스가 주장을 반증하는 결정적인 단서가 되었다.
1970년 허버트 아벨슨 (Herbert Abelson)과 루이스 랩스타인 (Louise Rapstein)은 쥐에서 임파종을 일으키는 Abelson murine leukemia virus 라는 바이러스를 발견한다[13] 이 바이러스 역시 RSV와 같이 RNA 지놈을 가진 레트로바이러스였으며, 이의 발견은 후에 필라델피아 염색체를 형성하는 9-22 전위의 기전을 밝힐 결정적인 단서를 제공하나, 이 두 가지의 서로 다른 발견이 어떻게 연관될지는 당시의 연구자들은 짐작하지 못했다. 물론 이들은 그들이 발견한 바이러스가 어떻게 ‘필라델피아 염색체’ 와 CML의 연구에 기여할 것이라고는 꿈에도 상상못했을 것이다. 이 연재에서 계속 언급될 것이지만 결국 기초과학은 애초에 기대한 것과 전혀 다른 새로운 ‘산물’ 들을 낳는 것이 그 본질인 셈이다.
다음 회에서는 전혀 다른 패러다임 (암은 염색체의 이상에서 발생된다 vs 암은 바이러스와 같은 병원체에 의해서 일어난다) 을 걷고 있던 것으로 생각되는 두가지의 연구가 어떻게 접접이 생기고 CML의 분자적인 기전이 밝혀지는지에 대해서 알아보도록 하자.
참고문헌
1. Bennett JH Case of hypertrophy of the spleen and liver in which death took place from the suppuration of the blood. Edinburgh Med Surg J 64: 413-423, 1845
2. Doyle AC Notes on a case of leucocythaemia. Lancet, 2490 1882
3. Painter TS. The Y-chromosome in mammals. Science. 1921 May 27;53(1378):503-4.; Nowell PC. Discovery of the Philadelphia chromosome: a personal perspective. Journal of Clinical Investigation. 2007 Aug 1;117(8):2033.
4. TIjo JH, Levan, A. The chromosome Number of man, Hereditas, 42:1-6, 1956; Ford C.E., Hamerton JL. The chromosomes of man. Nature. 178:1020–1023, 1956
5. Nowell PC, Hungerford DA. Chromosome studies on normal and leukemic human leukocytes. Journal of the National Cancer Institute. 1960 Jul 1;25(1):85-109.
6. Nowell PC, Hungerford DA. Chromosome studies in human leukemia. II. Chronic granulocytic leukemia. Journal of the National Cancer Institute. 1961 Nov 1;27(5):1013-35.
7. Sumner AT, Evans HJ, Buckland RA. New technique for distinguishing between human chromosomes. Nature New Biology. 1971 Jul 7;232(27):31-2.
8. Rowley JD. A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining. Nature. 1973 Jun 1;243(5405):290-3.
9. Rous P. A sarcoma of the fowl transmissible by an agent separable from the tumor cells. The Journal of experimental medicine. 1911 Apr 1;13(4):397.
10. Epstein MA, Achong BG, Barr YM. Virus particles in cultured lymphoblasts from Burkitt's lymphoma. The Lancet. 1964 Mar 28;283(7335):702-3
11. Temin HM, Rubin H. Characteristics of an assay for Rous sarcoma virus and Rous sarcoma cells in tissue culture. Virology. 1958 Dec 1;6(3):669-88.
12. Mizutani S, Boettiger D, Temin HM. A DNA-dependent DNA polymerase and a DNA endonuclease in virions of Rous sarcoma virus. Nature. 1970 Oct 31;228(5270):424-7.
13. Abelson HT, Rabstein LS. Lymphosarcoma: virus-induced thymic-independent disease in mice. Cancer research. 1970 Aug 1;30(8):2213-2







