기사본문
이수앱지스 피하주사 B형 혈우병치료제의 가능성
입력 2018-02-19 10:28 수정 2018-02-19 10:35
바이오스펙테이터 장종원 기자

이수앱지스는 국내에서 몇 안되는 의약품 개발 성공 경험을 가진 바이오텍이다. 2006년 항혈전치료제 '클로티냅(리오프로 바이오시밀러)'에 이어 2012년과 2014년 각각 고셔병치료제 '애브서틴(세레자임 바이오시밀러)', 파브리병 치료제 '파바갈(파브라자임 바이오시밀러)'을 허가받아 시장에 내놓았다. 이런 결과로 지난해 200억원에 육박하는 매출을 기록하기도 했다.
이에 이수앱지스의 가치를 허가받은 바이오시밀러 제품과 그 매출 등 기존 성과로 평가하는 시선이 있다. 하지만 회사의 미래를 열어줄 경쟁력 있는 신약 파이프라인 개발도 한창이다. 최근 스페인 마드리드서 개최된 '제11회 혈우병 및 유사질환 유럽연합학회 연례회의(EAHAD)'에 임상 1상 중간결과를 공개한 혈우병 치료제 'ISU304/CB 2679d(ISU304)'는 핵심 파이프라인 중 하나다.
◇혈우병 치료제 시장의 미충족 의료수요
이수앱지스는 2013년 미국 나스닥 상장사인 카탈리스트 바이오사이언스(Catalyst Biosciences)와 세계 최초 피하주사제형 B형 혈우병 치료제 개발에 돌입했다. 지난해 1상 돌입과 함께 미국 FDA와 유럽 EMA로부터 희귀의약품 지정도 받는 등 순조로운 출발을 보이고 있다.
먼저 혈우병은 선천적으로 혈액응고인자가 결핍돼 나타나는 유전성 출혈질환이다. 혈우병 환자는 대부분 A형과 B형으로 나뉘는데 제8번 혈액응고인자가 부족한 A형 혈우병이 전체의 80%, 제9형 혈액응고인자가 부족한 B형 혈우병이 나머지 20%를 차지한다. 이벨류에이트파마에 따르면 2017년 기준 치료제 시장 규모는 A형은 85억 5900만 달러(9조 2400억원), B형은 16억 4000만 달러(1조 7700억원)에 이른다.
혈우병 환자는 부족한 혈액응고인자를 보충하기 위해 치료제를 주기적으로 평생 투약해야 한다. 이로 인해 환자의 편의성이 무엇보다 중요한데 최근 약물 지속형 제품들이 시장에서 존재감을 드러내고 있다. 사노피가 최근 116억달러에 인수해 화제를 모은 바이오베라티브의 B형 혈우병 치료제 알프로릭스가 대표적. 알프로릭스는 기존 제품 대비 반감기를 늘려 주사 횟수(10~14일 간격으로 투여)를 줄여줘 환자의 편의성을 크게 개선했다. SK케미칼이 CSL베링에 기술수출한 A형 혈우병 치료제 앱스틸라도 주2회 투여 제품으로 주목받는다.
하지만 여전한 한계는 대부분의 치료제가 혈관에 직접 약을 투약하는 정맥주사 요법이라는 점이다. 정맥주사 방식은 혈관을 찾기 어려운 환자, 특히 소아 환자들에 큰 고통을 주고 있다. 또한 정맥주사 방식은 감염 문제에서도 자유롭지 않다.
이에 대안으로 등장하는 것이 피부 표면 아래 주사하는 피하주사다. 펜 모양의 주사기로 자가 주사하는 인슐린이 대표적인 피하주사다.
◇헤믈리브라를 통해 본 피하주사제형의 가능성
피하주사는 정맥주사와 같이 혈관을 찾을 필요가 없으며 병원 내원 횟수도 크게 줄일 수 있는 장점을 가지고 있다. 이 때문에 혈우병 치료제 시장의 게임 체인저로 주목받고 있다.
현재 시장에 나온 피하주사제형의 혈우병 치료제는 로슈의 A형 혈우병 치료제 헤믈리브라가 유일하다. 헤믈리브라는 주 1회 피하주사로 제형의 편의성과 지속효과 향상을 인정받아 작년 11월 미국 FDA로부터 최종 판매 승인을 받았다. 지난 1월에는 유럽 약물사용자문위원회(CHMP)로부터 허가 권고를 받아 유럽 판매 승인도 초읽기에 들어갔다.

▲헤믈리브라 매출 전망(이벨류에이트파마, 단위 : 백만 달러)
로슈는 53명의 성인 A형 혈우병 환자를 대상으로 한 임상 3상에서 혈우병 치료제를 투약하지 않은 환자들에 비해 평균 23.3회 헤믈리브라를 투여 받은 그룹의 출혈 발생률이 87%로 감소한 것을 검증해냈다. 또한 헤믈리브라를 투여한 19명의 A형 혈우병 소아 환자의 95%는 일체의 출혈을 일으키지 않은 것으로 나타났다.
피하주사제형의 헤믈리브라에 대한 시장 기대치는 상당하다. 시장조사업체 이벨류에이트파마는 헤믈리브라가 매년 급격한 매출신장을 통해 2021년 A형 혈우병 치료제 시장 1위에 등극할 것으로 예측했다. 매출 규모가 20억 9600만 달러로 시장점유율은 19%에 이를 전망이다. 2022년 매출은 26억 3200만 달러로 시장 점유율은 22%까치 치솟는다. 최초의 피하주사제형 B형 혈우병 치료제 ISU304에 대한 가능성을 엿볼 수 있는 대목이다.
◇임상 1상에서 본 ISU304의 가능성
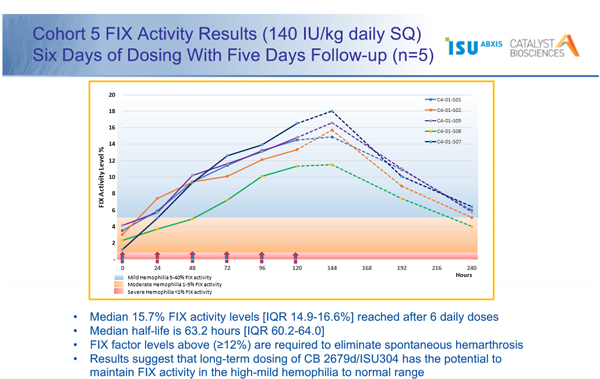
ISU304는 현재 B형 혈우병 치료제 시장 1위인 화이자 베네픽스를 개량해 피하주사제형으로 개발하는 제품이다. 작년 6월 첫 환자 투약을 시작으로 1년여간 4개 그룹(ISU304 베네픽스 정맥투여 비교군/ ISU304 정맥투여 피하투여 비교군 / 6일간 ISU304 투여군 등)으로 나눠 진행됐다.
먼저 ISU304는 베네픽스와 비교해 22배 효능(정맥투여시)이 높았고 반감기 역시 27시간(베네픽스는 21시간)으로 더 길었다. 이러한 우수한 효능을 활용해 피하투여 주사제형으로의 가능성을 확인했다.
또한 5명의 중증 혈우병 환자들을 대상으로 6일간 ‘ISU304’를 피하주사 방식으로 투약한 결과 혈액 내 제 9인자(FIX) 활성이 정상인 대비 16%까지 증가했다. 제 9인자 활성은 B형 혈우병의 심각도를 판단하는 기준으로 이번 임상시험에서 중증의 혈우병 환자를 경증 수준(5~40%)까지 회복시키는 것으로 나타났다. 투약 횟수를 늘릴 경우 경증 혈우병 환자의 응고인자 활성도는 정상 수준으로 유지될 수 있을 것으로 기대되는 대목이다.
주요 부작용은 경미한 통증 홍반 등이다. 단 한 환자에서는 첫번째, 두번째 주사 투여시 중등도의 부작용이 나타났다.
이수앱지스 관계자는 "임상을 통해 ISU304를 피하주사 방식으로 6일간 반복 투여했을 때 혈중 제 9인자 활성이 지속적으로 증가하는 것을 확인했다"면서 "올해 1상을 마무리하고 2상에 돌입할 계획"이라고 말했다. 2상에서는 ISU304의 투여 빈도를 줄이고 적정한 용량을 결정하는 작업을 진행할 계획이다.
한편 치료제 개발이 완료되면 이수앱지스는 국내 판매, 카탈리스트는 국외 판매 독점권을 갖게 된다. 양사는 협의된 비율로 국가별 수익을 배분하게 된다.







