기사본문
종양이질성 문제 극복할 교모세포종 신항원 'CSPG4' 발견
입력 2018-03-02 11:21 수정 2018-03-02 11:21
바이오스펙테이터 이은아 기자

악성 뇌종양을 치료하기 위한 새로운 표적 ‘CSPG4'를 발견했다. CSPG4(chondroitin sulfate proteoglycan 4)은 교모세포종에서 약 67%정도로 높게 발현하며, 종양을 둘러싼 신경교세포(glial cell)에 의해 유도되는 단백질이다.
연구진은 CSPG4를 겨냥하는 CAR-T세포로 교모세포종 마우스 모델 및 세포에서 종양 성장을 조절하고 생존기간을 연장시킨다는 사실을 확인했다. 항원 소실과 같은 종양회피(tumor escape) 기전이 일어나지 않았다는 점도 주목할 부분이다. 이번 연구는 미국 노스캐롤라이나대학교(University of North Carolina, UNC)와 이탈리아 밀라노 IRCCS 연구소(Istituto di Ricerca e Cura a Carattere Scientifico) 연구팀이 공동으로 수행했으며 ‘Science Translational Medicine' 저널에 지난달 28일 발표됐다.
교모세포종(Glioblastoma, GBM)은 원발성 악성 뇌종양으로 성장 속도가 가장 빠른 공격적인 암이다. 아직까지 치료 효과를 보이는 약은 없는데다 교모세포종으로 진단 후엔 평균 기대수명이 1년에 불과한 난치암이다. 2년 생존율은 약 26.5%, 5년 생존율은 약 9.8%이다.
그동안 교모세포종 치료제 개발이 어려웠던 이유는 혈뇌장벽(BBB, blood brain barrier) 투과가 어렵고, 종양 내에서도 유전적 성질이 다른 이질성(heterogeneity)으로 인해 치료에 대한 반응성에 차이가 있었기 때문이다.
연구진이 개발한 CSPG4-CAR-T는 두개 내(intracranial) 투여로 마우스모델에서 GBM-NS(neurosphere)의 성장을 효율적으로 조절했다. CSPG4이 저발현된 중등도 모델에서도 효과적이었다. 이는 종양을 둘러싸고 있는 미세아교세포(microglia)에서 분비된 TNFα에 의해 종양세포에서 CSPG4의 발현이 상향조절 됐기 때문이다. 치료 효능을 잠재적으로 증가시키는 메커니즘이 발견된 셈이다.
결과적으로 교모세포종에서 TNFα에 의해 유도된 CSPG4의 발현은 종양세포에서 유전자가 불균일하게 발현되는 이질성(heterogeneity) 등 종양회피 위험을 크게 감소시켰다.
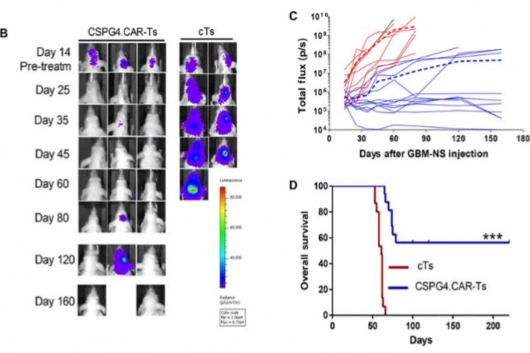
▲CSPG4 타깃 CAR-T세포의 종양성장 억제 효과(출처: Pellegatta et al.,2018, Science Translational Medicine, DOI: 10.1126/scitranslmed.aao2731)
이번 연구를 이끈 UNC의 Gianpietro Dotti 교수는 “교모세포종은 현재 이용 가능한 치료법으로 치유될 확률이 매우 낮다. 다른 임상연구를 통해 CAR-T세포가 교모세포종에서 작용할 수 있다는 사실은 알고 있다. 문제는 이전 실험에서 사용된 표적 항원은 최적의 효과를 내지 못한다는 것이다. 우리는 교모세포종에서 고발현하는 항원을 발견했다. CSPG4 타깃 CAR-T로 교모세포종 환자의 상당수에게 보다 효과적인 접근법을 제시할 것이다”고 강조했다.
그는 “좋은 항원은 종양세포에서 높은 비율로 발현하되 정상세포에서는 발현율이 낮아야 한다. 우리는 CSPG4가 종양의 67%에서 강하게 발현되는 것을 발견했다. 또한 종양 줄기세포인 암 유발 세포에서 발현되는 것도 확인했다. 종양 재발을 막는다는 점에서도 이러한 세포를 표적하는 것은 매우 중요하다. 그렇지 않으면 암은 다시 재발될 것이다”고 설명했다.
UNC 연구진와 UNC 의과대학팀은 교모세포종에 대한 임상시험을 시작할 예정이다. 추가수술이 필요한 재발·진행성 교모세포종 환자를 대상으로 한다. 향후 연구진은 독성 효과가 관찰되는 경우 T세포를 신속하게 제거할 수 있는 치료법인 ‘안전 스위치’도 통합할 계획이다.
현재 교모세포종 치료를 위해 약 6개의 항원을 겨냥한 CAR-T치료제 임상시험이 진행 중이다. EGFRvIII, IL13Rα2, HER2, EphA2, CMV, CD133, MUC1 등 이다.
펜실베니아 대학 연구팀은 EGFRvIII, 타깃 CAR-T세포로 임상1상에서 정맥투여를 통해 치료 가능성과 안전성을 확인했다. 전체생존율(OS) 중간값도 251일로 나타났다. 그러나 CAR-T-EGRFvIII 투여 후 환자 5명의 종양부위에서 EGFRvIII 발현량이 감소하는 것을 발견했다. CAR-T 투여 후 뇌종양이 변하면서 표적할 항원이 사라지는 종양 이질성 문제에 봉착한 것이다. 펜실베니아 연구진은 PD-1과 같은 면역관문억제제나 저분자 약물과의 병용요법으로 이를 해결할 수 있다고 예측하고 있다.
시티오브호프 연구진이 진행하고 있는 IL13Rα2 타깃 CAR-T 임상연구도 7.5개월동안 완전관해를 유지하는 놀라운 효과를 보였다. 임상시험에 사용된 CART-IL13Rα2(MB-101)는 미국 생명공학회사인 머스탱바이오(Mustang Bio)의 파이프라인이다. 정상조직을 표적하는 부작용을 줄이기 위해서 IL13Rα1와의 결합보다 IL13Rα2와의 결합력이 높은 세포막에 결합된(membrane-tethered) IL13 수용체 리간드(IL13)를 세포표면에 발현되도록 했다. Fc 수용체와의 off-target 상호작용을 줄이기 위해 IgG4-Fc 링커에 돌연변이도 포함시켰다. 또한 신호자극 보조인자인 41BB(CD137)를 추가해 항암효과를 높이고, 중추 기억T세포(central memory T)에서 CAR를 발현시킴으로써 CAR-T 치료 효과가 오래 지속되도록 했다.
그 외 안전성·종양 특이성 높인 iCAR-T(inhibitory CAR-T)과 CMVㆍHER2를 동시 겨냥하는 이중타깃 CAR-T도 개발 중이다.







