기사본문
독성 아밀로이드-TREM2 상호작용 첫 규명..AD 타깃?
입력 2018-03-12 09:29 수정 2018-03-16 09:10
바이오스펙테이터 김성민 기자
면역인자가 알츠하이머병을 치료할 수 있을까? 핵심 병리인자인 아밀로이드(Aβ)가 뇌속 면역세포인 미세아교세포(microglia)에 발현하고 있는 TREM2(triggering receptor expressed on myeloid cells 2) 수용체와 직접적인 상호작용과, 알츠하이머병 쥐에서 TREM2가 회복될 경우 질환을 늦추거나 혹은 치료할 수 있다는 것을 보여주는 논문 두편이 연달아 발표됐다. 이전에는 TREM2와 알츠하이머병과의 연관성은 밝혀져있었지만 실제 알츠하이머병을 일으키는 구체적인 메커니즘은 규명되지 않았다.
Sanford Burnham Prebys Medical Discovery Institute(SBP) 연구진은 지난 7일 뉴런(Neuron)에 'TREM2 Is a Receptor for β-Amyloid that Mediates Microglial Function', 'Elevated TREM2 Gene Dosage Reprograms Microglia Responsivity and Ameliorates Pathological Phenotypes in Alzheimer’s Disease Models'라는 제목의 논문을 발표했다.
TREM2는 가장 주목받고 있는 차세대 알츠하이머병 치료타깃이다. TREM2는 뇌속 면역세포인 미세아교세포(microglia)의 표면에 발현하는 수용체다. 미세아교세포는 뇌속 쓰레기를 제거하는 역할을 한다. TREM2의 바깥쪽은 아밀로이드, 사멸세포(apoptotic cell), 지질분자를 인식해, 안쪽 DAP12(혹은 DAP10)를 통한 신호전달과정을 활성화해 미세아교세포의 phagocytosis 등의 작용을 돕는다. 사람에서 유전적변이(ex. R47H, R62H)로 TREM2 기능에 이상이 생길 경우 전체적인 염증반응이 증가하고 아밀로이드, 타우의 축적이 가속화된다고 알려져 있다.
그러나 TREM2에 결합하는 리간드로 지질(lipids), ApoE가 알려져 있었지만 알츠하이머병과 미세아교세포와의 직접적인 연결성은 밝혀지지 않았다.
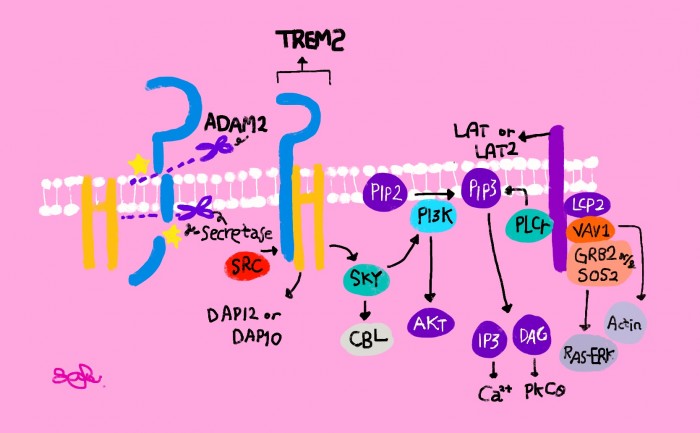
▲TREM2 신호전달 과정.
SBP 연구진이 이번에 새롭게 밝힌 내용을 요약하면 다음과 같다. 첫째 아밀로이드가 TREM2에 결합함으로써 미세아교세포의 작용이 활성화되는 것을 보였다. 다음으로 알츠하이머병 쥐모델에서 TREM2의 수준을 높임으로써 미세아교세포의 반응성이 높아지며 증상을 낮추는것을 증명했다.
핵심 독성단백질인 '올리고머 아밀로이드' TREM2에 특이적으로 결합...'질환모델에서 TREM2 높였더니 알츠하이머병 증 상 회복'
연구팀은 가장 먼저 기존에 알려진 아밀로이드 올리고머 수용체인 CD36, RAGE와 TREM2에 대한 결합력을 비교했다. 그결과 TREM2에 대한 결합력이 나노몰라 수준으로 가장 높았다(Kd=12.7). 반면 아밀로이드 모노머(monomer)는 TREM2에 거의 결합하지 않았다. 병리작용에 중추적인 독성단백질인 아밀로이드 올리고머가 TREM2에 특이적으로 결합한다는 것을 보여준 결과다.
아밀로이드는 미세아교세포의 TREM2에 결합해 K+ inward current를 형성해 탈분극화를 일으켜 전기적 활성화를 유도했다. 이에따라 미세아교세포는 사이토카인 IL-6, MIP-1α가 분비됐다. 분자 메커니즘으로는 하위신호전달과정으로 DAP12의 수준이 높아짐에 따라 SKY/GSK3β가 인산화(phosphorylation)가 일어났다. 반면 알츠하이머병 쥐모델에서 TREM2의 유전자를 없앨경우(KO) 미세아교세포가 아밀로이드를 제거작용이 현저히 낮아졌다.
다음 논문으로 연구진은 알츠하이머병 쥐모델(5xFAD)에 인간 TREM2를 발현하 BAC transgenic 모델을 만들었다. 흥미롭게도 5xFAD/BAC-TREM2 쥐에서 발현량 의존적으로 미세아교세포의 아밀로이드 대식작용이 촉진됐으며 인지행동 개선도 보였다. Xu 교수는 "TREM2는 잠재적인, 새로운 전략을 제시한다. TREM2 변이가 알츠하이머병 위험성이 제기돼 왔고, TREM2는 뇌를 보호하는 역할을 할 것으로 생각됐다"며 "우리의 연구는 구체적으로 TREM2가 어떻게 작동하는지, 더 나아가 TREM2를 높여 아밀로이드와의 상호작용을 증가시킴으로써 질병보호 역할을 한다는 것을 보여준다"고 강조했다.
덧붙여 그는 "초기 단계에서 미세아교포가 아밀로이드를 먹어치우는 작용이 유익할 수 있다"며 "그러나 과도하게 활성화시키게 되면 건강한 시냅스를 손상시키는 과도한 염증반응이 일어날 위험도 있다"고 부연했다.
아직까지 글로벌에서 TREM2를 겨냥한 치료제 개발은 초기단계며, 아직 임상에 돌입한 예는 없다. 현재까지는 항체로 TREM2를 활성화하는 접근방법이 주를 이룬다. 디날리테라퓨틱스(Denali therapeutics)는 BBB를 통과하는 이중항체를 이용해 TREM2를 타깃하는 agonistic 항체를 개발하고 있다. 프랑스 알렉토(Alector)가 TRME2 agonistic 단일클론항체 프로젝트를 진행한다.







