기사본문
AD서 타우 '역동성 추적'.."타우생산 조절 치료타깃 제시"
입력 2018-04-05 13:40 수정 2018-04-05 13:40
바이오스펙테이터 김성민 기자
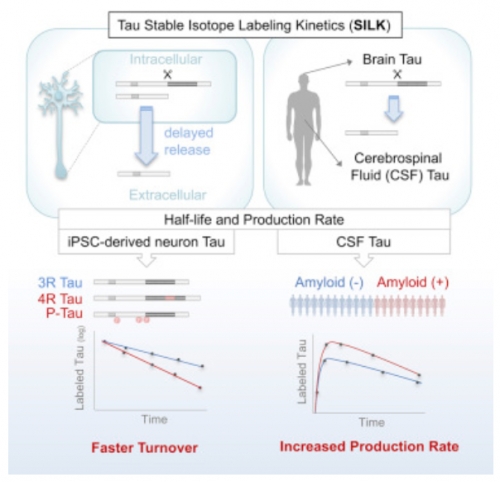
▲Tau Kinetics in Neurons and the Human Central Nervous System, 10.1016/j.neuron.2018.02.015
알츠하이머병 환자에서 병기진행에 따라 타우(Tau)가 증가하는 것은 잘 알려진 사실이다. 그러나 타우생성이 어떻게 시작되는지, 뇌에서 다양한 형태의 타우가 질환발병에 어떻게 관여하는지에 관해서는 밝혀지지 않은 상태다. 한가지 흥미로운 점은 이전에는 타우가 신경세포 안에 존재하는 단백질로 여겨졌다면, 최근에는 사실상 능동적으로 세포밖으로 배출되는 기전을 가진다는 증거들이 속속 보고되고 있다.
이러한 궁금증에 대한 답을 제시하기 위해 미국 세인트루이스 워싱턴대학교(Washington University) 연구팀이 타우의 동적 움직임을 추적한 논문결과를 최근 뉴런(Neuron)에 발표했다. Randall Bateman 교수는 "이 연구는 퇴행성 뇌질환에서 타우에 대한 우리의 생각을 바꾼다"며 "죽어가는 뉴런에서 타우를 방출한다고 생각했던 것과는 달리 병기진행과 연관된 타우는 능동적으로 배출되고 조절된다"고 강조했다. 또 이렇게 생성된 타우는 환자에서 아밀로이드 플라크 축적과 높은 연관성을 가졌다.
연구팀은 다양한 형태의 타우(isoforms, fragments)의 역동성(kinetics)을 추적하기 위해서 안정적인 역학적 동위원소지법(SILK. Stable Isotope Labeling Kinetics)과 질량분석법(mass spectrometry)을 사용했다. 타우 표지를 위한 트레이서로는 13C6-leucine를 이용해 시간에 따른 변화를 살펴봤다. 연구진은 SILK를 이용해 뇌척수액(CSF), 환자유래 역분화 줄기세포(iPSC, induced Pluripotent stem cells)-유래 뉴런에서 타우의 움직임을 관찰했다.
인간 iPSC에서는 새롭게 생산된 타우가 3일째되는 날, 잘린형태(truncated)의 N-terminal 타우절편이 인간 뉴런에서 능동적으로 배출됐다. 반면 죽어가는 뉴런의 세포밖에서 full-length 타우가 발견됐다. 인간 iPSC-유래 뉴런에서 타우의 반감기는 6.74 ± 0.45일, 건강한 일반인의 CSF에서는 23 ± 6.4일로 나타났다(N=10).
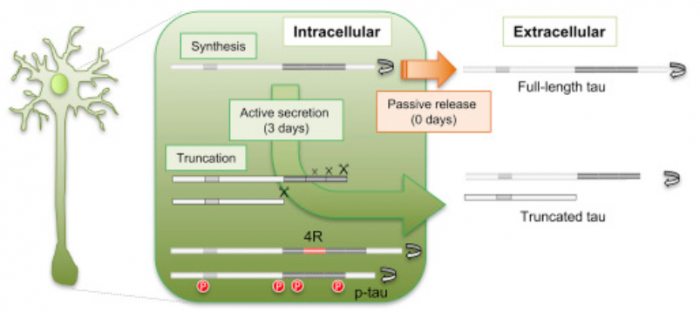
▲타우 생성과정, full-leng 타우와 truncated 타우의 세포밖 배출 및 반감기가 다르다는 것을 보였다.
대부분의 타우 단백질은 비슷한 반감기를 보였지만 4R(four-repeat) 타우 isoform, 인산화 타우는 더 빠른 반감기를 나타냈다. 4R 타우 isoform은 진행성 핵상마비(progressive supranuclear palsy), 피질기저핵변성(corticobasal degeneration) , 이마관자엽 치매(frontotemporal dementia) 등의 타우관련 질환에서 타우응집체를 형성하는 특징을 가진다. 인산화 타우는 타우-미세소관(microtuble) 상호작용을 조절해 신경돌기생성(neurite outgrowth), 축삭수송(axon transport)에 관여한다.
연구진은 "다양한 형태의 타우를 만드는 독특한 생산과정은, 이들 단백질이 독립적인 생물학적 활성을 가지고 있을 가능성을 보여준다"며 "우리가 추측하는 바로는 섬유화(fibrillogenic) 특성을 가진 형태가 더 빠른 역동성을 보이는 것으로 해석되며 이는 아밀로이드 isoform에서의 결과와 일치한다"고 제시했다.
다음으로 아밀로이드 플라크를 가지면서 경미한(mild) 알츠하이머병 증상을 보이는 24명의 환자에서 타우역동학을 관찰했다. 아밀로이드 PET을 이용해 축적정도를 확인했다. 흥미롭게도 타우 반감기가 아닌, 타우의 생산속도(production rate)가 아밀로이드 플라크의 축적과 연관성을 가지는 것을 확인했다. 아밀로이드 플라크와 타우 사이의 생물학적 연관성이 있음을 보여주는 데이터다.
Bateman 교수는 "우리는 플라크가 있는 사람에서 용해성 타우의 수준이 높다는 것을 알았다"며 "이제까지 그이유를 몰랐지만, 아밀로이드의 존재가 타우 생산을 증가시켰던 것이다"고 설명했다.
이번 연구가 갖는 의미는 뭘까? 알츠하이머병을 포함한 타우관련 질환에서 환자 CSF의 타우가 축적돼 있다는 것이 알려져있었다. 그러나 타우를 치료타깃 혹은 바이오마커로 이용하기 위해서 CSF에서 타우가 어떻게 증가하는지, 혹은 제거되는지에 관한 단서를 일부 제공한 것이다. 연구팀은 궁국적으로 세포밖으로 배출되는 타우생산을 조절하는 것이 또 다른 치료옵션이 될 수 있다고 설명했다.







![[인사]한미그룹 2026년 정기 임원인사](https://img.etoday.co.kr/crop/268/200/2071974.jpg)