기사본문
코오롱생과 "인보사 美 3상 하반기에..국내선 4천건 목표"
입력 2018-04-18 06:51 수정 2018-04-19 10:06
바이오스펙테이터 장종원 기자

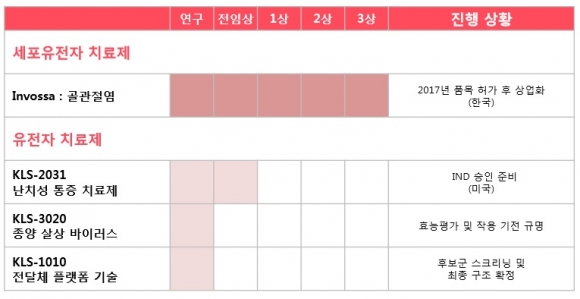
코오롱생명과학과 티슈진이 골관절염 유전자치료제 인보사케이주(인보사)와 관련해 국내에서는 적응증(환자군) 확대, 미국에서는 신약 허가를 위한 임상 3상을 본격화한다. 작년 11월 국내 판매에 돌입한 인보사는 현재까지 800건 이상 처방되며 시장에 확산하고 있다.
코오롱생명과학은 올해 난치성 신경병증 통증질환 치료제의 FDA 1상 승인을 받는 등 후속파이프라인 개발에도 적극 나설 계획이다.
코오롱생명과학은 17일 서울 여의도 증권거래소에서 열린 기업설명회에서 인보사 관련 추가(후속) 임상 계획 및 글로벌 기술수출 상황, 후속 파이프라인 개발 현황 등을 소개했다.
먼저 코오롱생명과학은 인보사의 국내 적응증 확대에 나선다. 코오롱생명과학은 작년 연말 인보사를 경증 골관절염 환자(Kellgren & Lawrence grade 2 이하)에게 처방하기 위한 임상3상 계획을 식품의약품안전처로부터 승인받았다. 총 17개 기관에서 146명을 대상으로 2년 동안 진행할 계획이다.
코오롱생명과학은 중국, 일본, 동남아 등에 인보사 기술이전도 추진하고 있다. 특히 일본의 경우 2016년 현지 미츠비시타나베 제약과 5000억원 규모(계약금 273억원)의 기술이전 계약이 이뤄졌으나 작년 연말 미츠비시타나베 제약이 권리를 반환하면서 새 파트너를 찾고 있다. 미츠비시타나베 제약은 계약금 반환까지 요구하고 있어 국제상업회의소(International Chamber of Commerce)의 규정에 따라 중재가 이뤄질 예정이다.
이에 대해 코오롱생명과학 관계자는 "파트너십은 해지가 된 상태로 계약금 관련 분쟁이 진행되고 있지만 우리는 반환 사유(임상 시약 생산처 변경, 임상 보류에 대한 부족한 설명)가 아니라고 판단한다"고 덧붙였다. 이 관계자는 "일본, 중국 등에서 새로운 파트너를 물색하고 있다. 이미 국내서 제품이 승인받아 시술 건수가 늘고 있는 점은 (기술이전에) 긍정적인 요인"이라면서 "동남아에서는 국내 임상만으로 시판 가능한 국가들이 있어 논의를 진행하고 있다"고 전했다.
인보사의 국내 판매 현황은 작년 11월 국내 출시돼 최근까지 830여건이 처방된 것으로 나타났다. 다음달이면 1000건 처방이 유력시되며 연내에는 4000건 돌파도 가능할 것이라는 전망이다. 국내 병원에 인보사를 론칭하는 작업이 계속되고 있어 시술건수는 빠르게 늘 것이라는 설명이다. 회사측은 "인보사는 개당 400만원 초반으로 (코오롱생명과학) 매출이 잡히고 현장에서는 평균 600만원 이상으로 시술되는 것으로 파악하고 있다"고 전했다.
코오롱생명과학은 인보사를 이를 후속 파이프라인 진행상황도 소개했다.
먼저 올해 하반기 난치성 신경병증 통증 치료제(KLS 2031)의 FDA 임상(1상) 승인을 기대하고 있다. GAD65, IL-10, GDNF 세 종의 치료유전자를 아데노 부속 바이러스를 이용해 신경조직에 전달하는 기전을 통해 난치성 신경병증 통증을 치료한다.
회사 관계자는 "작년 연말 FDA와 사전미팅을 가졌고 서류 등을 보완하고 있다"면서 '올해 하반기 FDA 임상 승인을 받아 내년 임상에 돌입할 계획"이라고 설명했다. 항암바이러스 치료제로 개발중인 KLS-3020은 현재 효능 평가 단계로 내년 FDA 1상 임상 승인 신청을 추진할 계획이다.
한편 인보사의 글로벌 판권을 가진 티슈진은 올해 하반기 임상 3상에 돌입한다. 현재는 티슈진이 임상시험용 의약품 생산 수탁기관(CMO)을 우시앱텍에서 론자로 변경하면서 임상 시험용 의약품 사용에 따른 FDA 승인 과정이 남은 상황으로 승인 획득 이후 임상 3상이 진행된다.
티슈진측은 "임상시험용 의약품의 품질 테스트를 마쳤으며 조만간 FDA에 관련 서류를 제출해 하반기 3상을 시작할 계획"이라면서 "골관절염 경증(grade 2), 중등도(grade 3) 환자 1000여명을 대상으로 하는 미국 임상은 병원 50~70곳에서 진행한다. 2021년 임상 종료, 2023년 상업화를 기대하고 있다"고 소개했다.







