기사본문
'탈리도마이드' 부작용 기전 '60년 만에' 밝혀져
입력 2018-08-06 06:36 수정 2018-08-28 07:02
바이오스펙테이터 김성민 기자
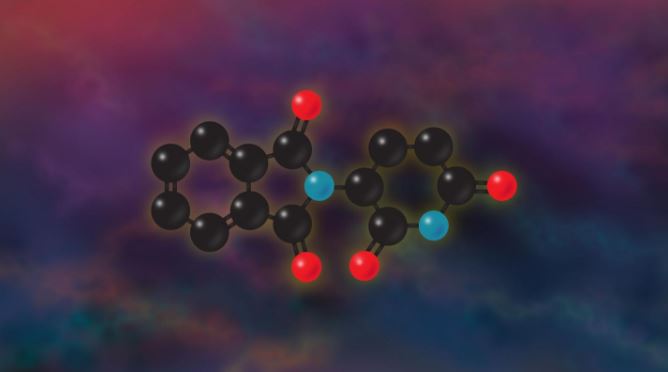
▲탈리도마이드 화학구조, 다나파버 암센터 제공
역사적으로 가장 다사다난한 약물인 탈리도마이드, 그 부작용에 대한 기전이 드디어 풀리는 걸까? 지난 60년간 몰랐던 탈리도마이드(thalidomide)의 부작용 메커니즘이 밝혀졌다. 다나파버 암센터(Dana-Farber Cancer Institute)는 탈리도마이드가 유전자 'on/off'를 조절하는 전사인자(transcription factor)인 'SALL4' 분해를 촉진하는 기전을 찾아냈다.
논문은 eLife에 'Thalidomide promotes degradation of SALL4, a transcription factor implicated in Duane Radial Ray Syndrome'라는 제목으로 지난 1일 게재됐다(doi: 10.7554/eLife.38430).
탈리도마이드는 현재 다발성골수종 치료제로 널리 사용되는 약물이지만, 굴곡진 역사를 가지고 있다. 독일 제약사인 그뤼넨탈은 1957년에 독일에서 시작해 전 세계로 탈리도마이드를 보급했다. 그뤼넨탈은 당시 탈리도마이드를 진정제나 수면제로 판매했다. 그러나 탈리도마이드를 임신한 여성의 입덧 방지용으로 처방하면서 문제가 생겼다. 1950년내 말부터 60년대 초까지 전 세계 46개국에서 기형아의 수가 1만 명을 넘었다. 임신 후 42일 안에 탈리도마이드를 단 한 알이라도 복용하면 100% 확률로 단지증, 눈과 귀 결함, 비정상 심장발달 등의 기형을 가진 아이가 태어난다는 것이 밝혀졌다. 탈리도마이드 사건은 최악의 의약품 부작용으로 기록됐다.
아이를 임신한 임부에게는 탈리도마이드를 허가하지 않은 미국에서는 부작용이 미미했다. 1960년 미국 식품의약국(FDA) 심사관으로 부임해, 첫번째 과제로 탈리도마이드 허가심사를 맡은 프랜시스 켈시는 전임상 자료에서 신경손상 부작용에 대한 근거가 불충분하다는 이유로 1년간 승인을 거절했다. 그리고 1년 후 탈리도마이드의 피해가 가시화되면서 옳은 판단이었다는 것이 확인됐다. 덕분에 미국에서 발생한 탈리도마이드 부작용은 17건에 그쳤다. 허가심사 이전에 미국 의사들에게 연구목적으로 나눠준 약으로 생긴 피해자였다. 탈리도마이드 사건은 미국과 유럽 등 각 나라 규제기관이 전임상에서 약물 효능과 안전성에 대한 기준과 약물승인 기준을 강화하는 계기가 됐다.... <계속>







