기사본문
[기고]2018년 노벨 생리의학상 수상의 시사점
입력 2018-10-10 06:43 수정 2018-10-10 07:21
도준상 포항공대 교수

2018년 노벨생리∙의학상을 면역관문억제제(immune checkpoint blockade) 개발에 대한 공로로 제임스 앨리슨 박사(미국 택사스대학 MD Anderson 암센터)와 타스쿠 혼조 박사(교토대)가 공동 수상한다는 발표가 났을 때 관련 분야 대부분의 사람들이 ‘놀랍지 않다’는 반응을 보였다. 2010년 이후 암치료의 대세로 자리잡고 있는 항암면역치료가 노벨상 주제가 될 것이라는 것과, 이 두 분이 노벨상을 수상할 것이라는 것은 모두가 예측하고 있을 정도로 자명한 일이었다. 언제 받을 것인가와 노벨상은 3명까지 받을 수 있으니 이 두 분을 제외하고 제3의 수상자가 누가 될 것인가 정도의 의문이 있었는데, 그것이 '올해'가 되고, '제3의 공동 수상자는 없다’는 정도가 약간의 놀라움이었다.
표준 항암 치료법으로 사용되어온 수술, 방사선요법, 화학요법의 경우 암세포를 직접적으로 제거하여 암을 치료한다는 점에서 공통점을 가진다. 반면, 항암면역치료법은 생체의 면역기능의 강화를 통해 간접적으로 암을 치료한다는 점에서 개념적으로 다른 치료법이다. 이러한 개념적 차이점(혹은 지나치게 혁신적인 개념) 때문에, 항암면역치료법은 최근까지 주류 종양학자들에게 외면당해왔다. 항암면역치료법이 본격적으로 주목받기 시작한 것은, 2010년 이후 면역관문억제제와 또 다른 항암면역치료법인 CAR-T(chimeric antigen receptor T) 세포치료법이 임상에서 놀라운 치료 효능을 입증하면서부터이며, 현재는 새로운 표준치료법으로서 자리잡아가고 있다.
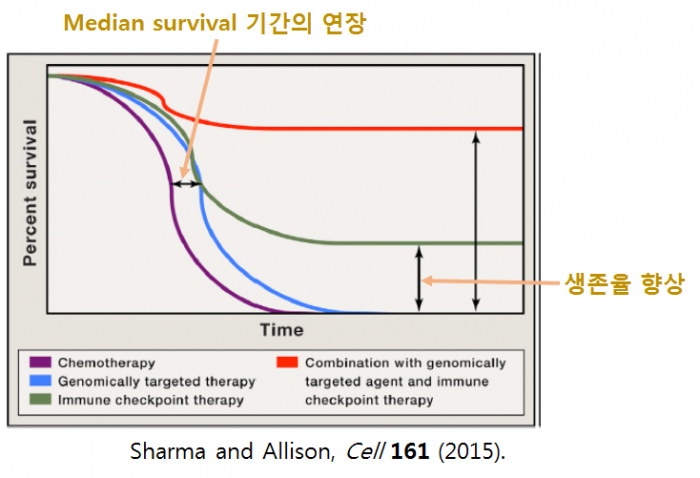
생체의 면역기능의 강화를 통하여 암을 치료하는 면역항암제가 기존 항암제와 치료 효능 측면에서 가지는 본질적인 차이는 앨리슨 박사가 2015년 Cell지에 발표한 논문의 그림을 보면 쉽게 이해할 수 있다. 기존 항암제가 난치성 종양환자의 중간 생존기간 (median survival)을 어느 정도 연장시켜주는 효능을 가졌다면(파란색 선), 면역항암제는(일부 환자이긴 하지만) 장기 생존(혹은 완치)을 가능하게 해 주는 치료법(녹색 선)이라는 측면에서 본질적인 차이를 가진다. 이러한 차이점은 기존 항암제가 암세포를 단순히 죽이는데 반해, 면역항암제는 면역 세포의 활성화 및 면역 기억 형성을 통하여 보다 능동적으로 암세포에 대응하는 본질적인 기전의 차이에서 기인한다.
중요한 점은, 이러한 면역항암제가 원래 ‘항암제’를 목표로 개발된 것이 아니라 ‘기초연구’ 과정의 부산물로서 개발되었다는 것이다. 1990년을 전후로 면역 활성에 관여되는 많은 분자들이 발견되고 그 기능을 규명하는 연구가 활발하게 이루어지기 시작하였다. 가장 먼저 밝혀진 것이 면역기능의 가속 페달에 해당하는 기능을 가지는 CD28이고, 이후 발견된 CTLA-4는 CD28와 비슷한 구조와 동일한 리간드를 가지는 측면에서 처음에는 또 다른 가속 페달의 기능을 가질 것이라고 사람들이 추정하고 있었다. CTLA-4의 기능을 차단하는 항체인 anti-CTLA-4를 개발한 이유는, CTLA-4의 기능을 규명하기 위함이었으며, 이를 통하여 CTLA-4가 면역기능을 향상시키는 가속 페달이 아닌 면역 기능을 저해하는 브레이크 기능을 가지는 것을 밝히게 된다.
흥미로운 것은, anti-CTLA-4를 이용한 CTLA-4의 기능을 규명하는 연구를 앨리슨 박사가 최초로 한 것이 아니라는 것이다. 1994년 CTLA-4의 ‘negative immune regulator’로서의 기능을 최초로 당시 신생 저널인 Immunity에 발표한 제프 블루스톤 박사는 이후 CTLA-4의 면역억제 기능에 주로 초점을 맞춰 다양한 자가면역질환 치료에 전념한다. 반면 1년 뒤인 1995년 Journal of Experimental Medicine(JEM)에 또 다른 anti-CTLA-4 항체를 이용하여 비슷한 내용을 발표한 앨리슨 박사는 ‘발상의 전환’을 통하여 anti-CTLA-4가 면역기능의 억제를 풀어 면역기능을 활성화시켜 암을 치료할 수 있는 ‘새로운 개념의 항암제’로서 활용 가능하지 않을까라고 생각하게 되고, 이러한 발상의 전환이 노벨상 수상의 근간이 되었다. 이러한 개념은 생쥐 모델에서 anti-CTLA-4의 항암 효능을 검증한 결과를 1996년 Science에 발표하면서 학문적으로 인정받게 된다.
그러나, ‘면역기능 향상을 통하여 암을 치료한다’는 개념은 당시 지나치게 혁신적인 것이라 주류 제약업계에서 받아들이지 않아 큰 어려움을 겪게 된다. 우여곡절 끝에 결국 Medarex라는 회사를 통하여 임상에 사용할 수 있는 항체를 만들고, 2003년 PNAS에 임상 1상 결과를 발표하게 된다. 이후 Medarex를 인수한 BMS가 2010년 New England Journal of Medicine(NEJM)에 anti-CTLA-4의 임상 3상 성공 논문을 게재하고, 2011년 미국 FDA 승인을 받으면서 본격적인 항암면역치료제 시대가 열리게 된다.
앨리슨 박사가 CTLA-4의 기능 연구에서 발상의 전환을 통하여 면역관문억제제 개념을 제시하고 증명하였다면, 혼조 박사는 새로운 면역관문분자인 PD-1을 최초로 발견하고(1992년 EMBO Journal), PD-1이 결핍한 쥐를 만들어서 그 기능을 규명(1999년 Immunity)하는 등 PD-1 관련 기초 연구의 상당부분을 주도하였다. 재미있는 일화는 PD-1 결핍 쥐를 만들었는데, 쥐가 태어난 후 3개월 동안 너무 건강하여 관련 연구를 수행한 학생이 스트레스를 받았다는 것이다. 수개월의 기다림 후에 PD-1 결핍 쥐에서 자가면역질환이 발견되어 PD-1의 ‘negative immune regulator’로서의 기능이 증명되는데, 이것은 CTLA-4 결핍 쥐가 수 주 이내에 심각한 자가면역질환으로 죽는 것과 대비되는 결과로, anti-PD-1이 anti-CTLA-4에 비해 훨씬 더 부작용이 적을 수 있다는 것을 암시한다. 이러한 결과에 기반하여, 혼조 박사는 anti-PD-1이 anti-CTLA-4와 같은 면역관문억제 기반의 항암제로 작용할 수 있을 뿐만 아니라 부작용이 더 적어, 보다 보편적으로 활용 가능할 것이라는 가능성을 보게 되고, 관련 연구를 본격적으로 착수하게 된다.
학문간의 경계에 대해 보수적이고 제약관련 산업이 상대적으로 약한 일본에서 기초 면역학을 전공한 혼조 박사가 anti-PD-1을 신개념의 항암제로 추진하기 위해 걸어야 했던 길은 험난했다. 우선 교토대학에서 관련 경험이 없어 ‘산업체 파트너 없이 특허를 지원해줄 수 없다’고 하여 예전에 다른 일로 협력했던 Ono Pharmaceutical을 통하여 특허를 출원할 수 밖에 없었으며, Ono의 역량 또한 임상을 위한 항체 개발 및 임상시험을 하기에는 부족했기에 결국 미국의 Medarex를 통하여 임상용 항체를 제조할 수 밖에 없었다.
2009년 Medarex를 인수한 BMS는 항암면역치료의 강자로 부상하게 되고, 이는 일본 입장에서는 자국에서 개발한 신개념 블록버스터 신약이 다국적 제약회사로 넘어가게 된 뼈아픈 경험이 아니었을까 생각된다. Anti-PD-1은 2012년 이후 다수의 NEJM 논문을 통하여 임상 약효의 수월성을 입증하고, 2014년에 FDA 승인을 받게 되고 (BMS와 Merck), anti-CTLA-4에 비해 더 부작용이 적고 효능이 좋아, 현재 가장 보편적으로 사용되고 있는 항암면역치료제로 자리잡게 되었다.
이렇게 기초연구가 발상의 전환을 통해 많은 암환자를 치료한 신개념의 항암제가 되었으며, 그 공적을 인정받아 앨리슨 박사와 혼조 박사가 2018년 노벨 생리의학상을 공동 수상하게 된 것이다. 이 두 분의 공적이 워낙 탁월하여 이 분들의 노벨상 수상에 있어서 대부분 큰 이견이 없을 것이라 생각하지만, 이러한 성공의 이면에서 노력한 수 많은 unsung heroes들의 공적 또한 무시할 수 없을 것이다.
‘항암면역치료’라는 개념 자체가 받아들여지지 않던 어려운 시절의 정신적 지주 역할을 한 Lloyd Old 박사(현대 항암면역치료의 아버지라 불리우며, 2011년 전립선 암으로 돌아가지 않으셨다면 공동 수상했을 가능성이 컸다고 개인적으로 생각)를 포함한 관련 연구를 소신있게 수행한 연구자들 (Lieping Chen, Robert Schreiber, Steven Rosenberg 등), 많은 제약회사들이 외면할 때 항암면역치료제 개발 및 임상시험을 추진한 Medarex와 BMS의 과학자 및 경영진들(Francis Cuss, Axel Hoos 등), 새로운 개념의 항암치료제의 임상 적용에 앞장서 결국 임상시험을 성공시킨 의사들(Stephen Hodi, Jedd Wolchok 등) 및 관련 연구를 묵묵히 수행한 수 많은 학생/연구원들(필자의 포닥 지도교수인 Max Krummel 등)의 노력 등이 모두 합쳐져서 오늘의 영광이 가능하게 된 것이다.
앨리슨 박사와 혼조 박사는 기초과학에서 시작하였다는 점과, 자신의 연구 결과가 항암치료에 활용 가능할 것이라는 신념을 가지게 된 이후로 주변의 회의적인 시선에 굴하지 않고 소신있게 끝까지 추진하였다는 점에서 공통점을 가지며, 이러한 점이 후학들에게 많은 시사점을 준다고 생각한다.
참고문헌
1. Ishida, Y., Agata, Y., Shibahara, K., & Honjo, T. (1992). Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J., 11, 3887.
2. Krummel, M. F., & Allison, J. P. (1995). CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation. J. Exp. Med., 182, 459.
3. Leach, D. R., Krummel, M. F., & Allison, J. P. (1996). Enhancement of antitumor immunity by CTLA-4 blockade. Science, 271, 1734.
4. Nishimura, H., Nose, M., Hiai, H., Minato, N., & Honjo, T. (1999). Development of Lupus-like Autoimmune Diseases by Disruption of the PD-1 gene encoding an ITIM motif-carrying immunoreceptor. Immunity, 11, 141.
5. Hodi, F.S., Mihm, M.C., Soiffer, R.J., Haluska, F.G., Butler, M., Seiden, M.V., Davis, T., Henry-Spires, R., MacRae, S., Willman, A., Padera, R., Jaklitsch, M.T., Shankar, S., Chen, T.C., Korman, A., Allison, J.P. & Dranoff, G. (2003). Biologic activity of cytotoxic T lymphocyte-associated antigen 4 antibody blockade in previously vaccinated metastatic melanoma and ovarian carcinoma patients. Proc Natl Acad Sci USA, 100, 4712.
6. Hodi, F.S., O’Day, S.J., McDermott, D.F., Weber, R.W., Sosman, J.A., Haanen, J.B., Gonzalez, R., Robert, C., Schadendorf, D., Hassel, J.C., Akerlet, W., vea den Wertwegh, A.J.M., Lutzky, J., Lorigan, P., Vaubel, J.M., Linette, G.P., Hogg, D., Ottensmeier, C.H., Lebbe, C., Peschel, C., Quirt, I., Clark, J.I., Wolchok, J.D., Weber, J.S., Tian, J., Yellin, M.J., Nichol, G.M., Hoow, A., and Urba, W.J., (2010). Improved Survival with Ipilimumab in patients with metastatic melanoma. N Engl. J. Med. 363, 711.







