기사본문
[남궁석의 신약연구史]신장-혈압 연결고리, '코자'의 탄생
입력 2019-03-06 13:43 수정 2019-03-06 13:43
남궁석 SLMS(Secret Lab of Mad Scientist) 대표
지난 연재에서는 약물 요법에 의해서 최초로 혈압 조절을 가능케 한 이뇨제와 베타 차단제 발견의 역사를 알아보았다. 이번 연재에서는 혈압조절과 밀접한 관련이 있는 호르몬계인 레닌-안지오텐신계(Renin-angiotension system)에 관련된 발견의 역사와 이를 조절함으로써 혈압 조절을 가능케 한 안지오텐신 전환효소 억제제(angiotensin converting enzyme inhibitor, ACE inhibitor)와 안지오텐신 수용체 차단제(angiotensin receptor blocker, ARB)의 개발과정을 알아보도록 한다.
레닌 Renin의 발견
신장의 이상과 고혈압, 그리고 좌심실비대증(hypertrophy) 등이 서로 연관관계가 있다는 것은 19세기의 의사들도 깨달았다. 그러나 신장에서의 이상이 어떻게 고혈압과 심장 이상으로 연관되는지에 대한 정확한 이해까지 이르지는 못했다.
신장과 혈압 조절과의 직접적인 연결고리가 되는 레닌-안지오텐신계(Renin-angiotensin system)의 발견 계기는 1898년 핀란드 출신 생리학자인 로베르트 티거스테트(Robert Tigerstedt, 1853-1923)의 발견이었다. 그와 그의 학생인 퍼 군나르 버그만(Per Gunnar Bergm)은 토끼의 신장 피질(Renal Cortex) 조직의 추출물을 주사하자 혈압이 즉시 상승하는 것을 발견하였다. 그런데 기이하게도 신장 수질(Renal medulla) 유래의 추출물에서는 그러한 효과가 보이지 않았다. 티거스테트는 신장 피질에서 분비되는 물질이 혈압 상승 효과를 가져온다는 가설을 세우고, 이 신장 유래의 혈압상승 물질을 ‘레닌’(Renin)이라고 이름지었다[1].
그러나 티거스테트는 스웨덴에서 핀란드로 귀국한 1901년 이후에는 소속기관의 행정업무 때문에 별다른 후속 연구를 수행하지 못하였고, 그의 연구 결과는 당대의 학자들에게 큰 영향을 주지 못하였다.
티거스테트의 레닌의 발견 이후에 신장과 고혈압의 관계는 그다지 많이 연구되지 않았다. 그러나 1930년대에 미국 클리블랜드의 케이스 웨스턴 리저브 의대의 병리학자 해리 골드블라트(Harry Goldblatt, 1891-1977)가 개를 이용한 고혈압 모델 동물을 만든 이후에 그 관심이 다시 높아지게 되었다. 골드블라트는 고혈압으로 사망한 환자 중에서 신장 혈관이 좁아져 있는 것을 발견했다. 그는 신장으로의 혈관 유입이 감소하는 것이 고혈압을 유발하는 것이 아닌가 하는 가설을 세우고, 이를 입증하기 위하여 개의 신장 동맥을 클램프로 조여 혈관을 부분적으로 조여 보았다. 그러자 개의 혈압은 즉시 올라갔다. 반면 췌장이나 대퇴 동맥을 비슷하게 조여도 혈압에는 변화가 없었다[2]. 즉 골드블라트의 가설대로 신장으로의 혈관 유입이 몸 전체에서의 혈압 상승을 유도한다는 것을 입증하는 결과였다.
이러한 결과로 신장과 고혈압과의 관계는 다시 주목을 받기 시작하였으며, 티거스테트가 30년 전에 보고한 신장 유래의 혈압 상승 유도물질인 ‘레닌’의 정체를 파악하고자 하는 노력이 다시 시작되기 시작하였다.
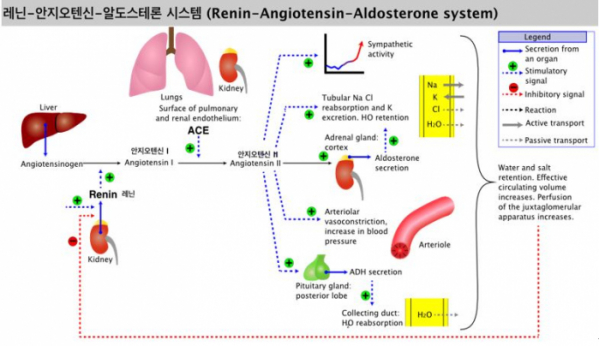
▲그림 1. 레닌-안지오텐신-알도스테론 시스템 (Renin-angiotensin-aldosterone system)은 간에서 분비되는 안지오텐시노겐 (Angiotensinogen)이 신장 피질에서 분비되는 레닌 (Renin)과 안지오텐신 전환효소 (Angiotensin converting enzyme, ACE)에 의해서 안지오텐신 II 가 되어 동맥의 수축, 알도스테론의 분비에 의한 물 및 이온 체류 등의 다양한 생리현상을 조절하는 호르몬계를 총칭하여 이야기한다. 안지오텐신 II는 혈압 상승을 유발하는 원인 물질이다. By Soupvector - Own work, CC BY-SA 4.0, https://commons.wikimedia.org/w/index.php?curid=66583851
안지오텐신과 안지오텐신 변환 효소(Angiotensin Converting Enzyme)와 혈압 조절의 관계
장에서 분비되는 혈압 상승 물질의 정체를 규명하고자 이를 정제하려고 했던 연구자들은 곧 난관에 직면하였다. 즉, 신장 유래의 추출물은 정제하지 않은 상태에서는 강력한 혈압 상승 효과를 보였지만, 단백질 정제를 시작하기 위한 첫 단계인 투석(Dialysis)를 하는 순간 그 활성을 잃어버렸다. 그러나 기묘하게도 정상적인(고혈압이 아닌) 개 유래의 혈액과 투석을 통하여 혈압 상승 효과를 잃은 신장 유래 추출물을 섞어주니 혈압 상승 효과가 다시 되살아났다[3]. 이러한 발견은 결국 신장에서 분비되는 ‘레닌’ 그 자체는 혈압 상승을 일으키는 원인물질이 아닌 다른 물질을 활성화시켜주는 물질이라는 결론에 이르렀다.
1939-1940년, 아르헨티나 부에노스아이레스의 생리학 연구소의 연구팀과 미국 릴리사(Lilly Laboratory)의 어빈 페이지(Irvine H Page, 1901-1991)는 각각 하이퍼텐신(Hypertensin)과 안지오토닌(angiotonin)이라고 불리는 혈압 상승의 원인 물질을 발견하였다[4]. 이 물질은 신장에서 분비되는 레닌에 의해서 만들어지는 물질로, 곧 동일한 물질임이 밝혀졌고 이 물질은 우리가 현재 안지오텐신(angiotensin)이라고 부르는 물질이 된다.
1954년 안지오텐신은 두 종류로 나뉜다는 것이 밝혀졌다[5]. 즉, 레닌에 의해서 생성되는 것은 안지오텐신 I 이고, 이것이 다시 안지오텐신 II로 변환되는데, 결국 혈압상승의 매개물질이 되는 것은 안지오텐신 II 가 된다. 안지오텐신 I 은 452개의 아미노산으로 이루어진 안지오텐시노겐(angiotensinogen)이 단백질 분해효소인 레닌에 의해서 절단되어 생성되는 10개의 아미노산으로 구성되어 있으며, 안지오텐신 II 는 나중에 안지오텐신 변환 효소(Angiotensin converting enzyme, ACE)라고 알려진 단백질 분해 효소에 의해서 형성된 8개의 아미노산으로 구성된 호르몬이 된다는 것이 1956년에 알려지게 되었다[6]. 안지오텐신 II는 동맥의 수축효과를 유발하여 혈압 상승을 유발할 뿐만 아니라 부신피질에서 분비되어 신장의 네프론에서 소듐과 물의 재흡수와 포타슘의 방출을 증가시키는 스테로이드 호르몬인 알도스테론(Aldosterone)의 방출을 유도한다.
안지오텐신 변환 효소 억제제(ACE inhibitor)와 혈압 조절
이렇게 레닌-안지오텐신 시스템과 그의 혈압 조절에 대한 광범위한 연관성이 밝혀지면서 서서히 레닌-안지오텐신 시스템을 억제함으로써 혈압 조절을 할 수 있을 것이라는 가능성이 떠오르게 되었다.
1968년 ACE의 활성이 브라질산 살무사 유래의 독소에 함유되어 있는 펩타이드에 의해서 억제된다는 것이 알려진 이후[7], ACE 의 활성을 억제하는 화합물의 탐색에 대한 관심이 생기게 되었다. ER 스큅스 앤 썬스(ER Squibb and Sons, 현재는 BMS의 일부가 되었다)의 연구자들은 처음에는 뱀 독소 유래의 ACE 활성 저해 펩타이드를 분리하여 정제하고자 하였다. 1971년 이들은 일련의 ACE 활성 저해 펩타이드를 분리하였고, 이를 12명의 고혈압 환자에 투여하였을때 이완기 혈압을 126±3mmHg에서 101±4 mm Hg로 감소시키는 효과를 보여줌을 확인하였다[8].
그러나 이 펩타이드의 임상 개발은 더이상 진행되지 못하였는데, 펩타이드 제형으로 인해 경구 투여가 불가능하다는 점, 그리고 생산 단가의 문제 때문에 경제성이 없다고 판단되었기 때문이다[9].
이들은 전략을 바꾸어 경구 투여가 가능한 소분자 화합물의 개발을 추진하기로 하였다. 그렇다면 ACE를 저해하는 소분자 화합물을 어디서부터 개발해야만 할까? 연구자들은 ACE가 안지오텐신 II 의 C말단에서 세번째 펩타이드 결합을 분해하여 두 개의 아미노산을 떼어내는 단백질 분해효소인데, 이 특성은 기존에 잘 알려진 카르복시펩티다아제 A 와 유사하다는 것에 착안했다(카르복시펩티다아제 A는 C 말단에서 마지막 아미노산 1개를 분해하는 효소이다). 때마침 벤질숙신산 (Benzylsuccinic acids)가 카르복시펩티다아제를 저해한다는 연구 결과를 접하고[10], 이것을 응용하여 ACE의 저해 물질을 만들 수 있을지를 생각하였다.
이들은 카르복시펩티다아제 A에 존재하는 2가 아연(Zn2+)과 숙신산의 카르복실기의 결합이 단백질 분해효소의 저해에 필요하다는 가설 하에 숙신산과 기존에 ACE를 저해하는 펩타이드에 공통적으로 존재하는 프롤린 잔기를 결합한 화합물을 만들어 보았다. 이 화합물은 ACE의 저해 능력은 매우 낮았으나, 연구자들의 가설을 입증하는데는 성공하였고, 이 화합물 변이체의 하나인 SQ14225라는 화합물은 ACE를 매우 강력하게 저해하였다[11].
SQ14225는 캅토프릴(Captopril)이라는 정식 성분명이 되었고, 1981년 FDA로부터 사용이 허가되었다. 한편 같은 타겟을 저해하는 경쟁약물로 머크(Merck)는 에날라프릴(Enalapril)을 개발하였고, 이는 1984년 FDA로부터 판매 승인을 얻게 되었다.
![▲그림 2. ACE 저해제의 디자인. ACE 저해제는 이를 저해하는 뱀 독소 기반의 펩타이드와 ACE 와 비슷한 효소 작동 기전을 카르복실펩티다아제 A (Carboxypeptidase A) 의 구조 정보를 참조하여 디자인되었다 [11]. 카르복실펩티다아제 A와 ACE는 공통적으로 촉매 반응에 필수적인 아연 금속이온이 존재하고, 카르복실펩티다아제 A를 저해하는 저해제의 카르복실기가 여기에 결합하는 가설에 근거하여 기존에 뱀 독소 기반의 ACE 저해 펩타이드에 존재하던 프롤린을 결합시킨 리드 컴파운드 (Lead compound)를 설계하였다. 이를 설피드릴기로 치환하여 좀 더 강한 저해 활성을 얻게 되었다. 후에 규명된 ACE 저해제와 캅토프릴 (Captopril)의 결합 구조를 보면 캅토프릴의 설피드릴기가 ACE 에 존재하는 아연 이온과 결합함을 확인할 수 있었다.](http://img.etoday.co.kr/pto_db/2019/03/600/20190305195027_1307505_1200_778.png)
▲그림 2. ACE 저해제의 디자인. ACE 저해제는 이를 저해하는 뱀 독소 기반의 펩타이드와 ACE 와 비슷한 효소 작동 기전을 카르복실펩티다아제 A (Carboxypeptidase A) 의 구조 정보를 참조하여 디자인되었다 [11]. 카르복실펩티다아제 A와 ACE는 공통적으로 촉매 반응에 필수적인 아연 금속이온이 존재하고, 카르복실펩티다아제 A를 저해하는 저해제의 카르복실기가 여기에 결합하는 가설에 근거하여 기존에 뱀 독소 기반의 ACE 저해 펩타이드에 존재하던 프롤린을 결합시킨 리드 컴파운드 (Lead compound)를 설계하였다. 이를 설피드릴기로 치환하여 좀 더 강한 저해 활성을 얻게 되었다. 후에 규명된 ACE 저해제와 캅토프릴 (Captopril)의 결합 구조를 보면 캅토프릴의 설피드릴기가 ACE 에 존재하는 아연 이온과 결합함을 확인할 수 있었다.
이러한 ACE 억제제가 등장하였을때는 시장에 다른 기전의 혈압 조절제가 이미 오래 전에 등장한 상태였고, 새로운 기전의 혈압 조절제가 폭넓게 사용되기 위해서는이들의 임상적 효용성이 입증되어야만 했다. 이러한 상황은 1980년대 말과 90년대 초반에 수행된 두 종류의 임상시험 결과가 발표되면서 크게 바뀌게 되었다. 1987년 NEJM에 보고된 'Cooperative North Scandinavian Enalapril Survival Study(CONSENSUS)'라는 임상시험에서는 253명의 울혈성 심부전(Congestive heart failure) 환자를 대상으로 에날라프릴 복용군과 위약군에 대해서 이중맹검 방식으로 사망 위험도를 확인하였다. 그 결과 에날라프릴 복용군의 사망 위험도가 대조군에 비해서 27% 감소되는 결과를 확인하였다[12]. 한편 1992년 보고된 좌심실 기능부전(Left ventricular dysfunction) 환자를 대상으로 한 캅토프릴 임상 시험에서는 캅토프릴 복용군이 대조군에 비해서 사망율이 20% 감소한다는 것이 보고되었다[13]. 이러한 임상시험 결과는 ACE 저해제의 폭넓은 활용의 임상적 근거로 활용되기 시작하였고, ACE 저해제는 혈압 조절의 새로운 수단으로 사용되기 시작하였다.
안지오텐신 수용체 차단제(Angiotensin Receptor Blocker)의 개발
ACE 억제제의 경우 탁월한 혈압 강하 효과를 보였고, 심부전 환자를 대상으로 한 임상시험에서 극적으로 사망률을 낮추어 주는 효과를 보여 1990년대 이후에 혈압 강하제로 널리 사용되게 되었다. 그러나 한 가지 단점이 있었는데, 안지오텐신 I을 안지오텐신 II로 바꾸는 ACE는 다른 펩타이드 호르몬인 브라디키닌(Bradikinin)의 분해에도 관여하며, 브라디키닌은 혈관 확장을 유도한다. 그런데 ACE 억제제에 의해서 브라디키닌이 축적되면, 이것은 일부 사람에게서 마른 기침의 원인이 되며, 심한 경우에는 혈관성 부종의 원인이 되기도 한다. (이 글을 쓰고 있는 필자 역시 ACE 억제제를 복용하면 심한 마른 기침을 하는 부작용을 경험하여 ACE 억제제 대신 안지오텐신 수용체 차단제로 약물을 바꾼 경험이 있다)
그렇다면 ACE 대신 레닌-안지오텐신계의 다른 부위를 차단하여 안지오텐신 II의 기능을 억제하는 것은 어떨까? 사실 안지오텐신 II 의 혈압 상승 효과가 규명되던 1960년대 말에서 1970년대까지 안지오텐신 II의 펩타이드 유사체인 사라라신(Saralasin)가 안지오텐신 II 수용체의 부분적 길항제(Partial antagonist)로 작용한다는 것이 알려졌다[14]. 사라라신은 안지오텐신 II의 첫번째와 마지막 아미노산이 변형된 펩타이드 유사체였다. 그러나 최초의 ACE 저해제와 마찬가지로 이는 펩타이드계 물질로써 경구 투여가 불가능하며, 지속성이 낮았으며 부분적 길항제로써 그 자체로는 약물로의 가치가 없었다. 그러나 사라라신은 안지오텐신 II에 의한 혈압 상승을 억제한다는 것을 보임으로써 실제로 안지오텐신 II 수용체가 혈압 조절을 위한 타겟으로 작용할 수 있다는 것을 보여주었다는 의미가 있다.
1970년대 말부터 안지오텐신 II 수용체에 결합하여 안지오텐신 II에 의한 혈압 상승을 억제하는 소분자 화합물을 찾으려는 노력들이 듀퐁(Du Pont)을 비롯한 여러 제약회사에서 시작되었다. 그런데 1982년 일본의 다케다(Takeda)에서 약한 활성을 가진 소분자 화합물 안지오텐신 II 수용체 길항제를 발견했다는 소식이 특허 공개를 통해 알려졌고, 이를 통해 다른 제약회사들 역시 비슷한 화합물을 찾기 위한 경쟁에 뛰어들었다[15].
다케다에서 찾은 리드 컴파운드(lead compounds)들은 15uM에서 40uM정도의 매우 낮은 IC50을 가지는 화합물이었다. 연구자들은 이들이 안지오텐신 II 수용체에 붙기는 하지만 이의 결합력이 신통치 않기 때문에 낮은 활성을 보이는 것이라고 생각했다. 즉 이 화합물은 아마도 안지오텐신 II 의 구조와 유사하기는 하지만 충분히 크지 않기 때문에 화합물을 확장하여 안지오텐신 II 수용체와의 결합력을 높여보려고 했다.
안지오텐신 II 의 C말단 카르복실기는 기존 연구에 의해서 안지오텐신 II 수용체와의 결합에 필수적이라고 알려져 있었다. 이들은 다케다에서 찾은 리드 컴파운드의 피롤기에 달려 있는 카르복실기가 이와 비슷한 역할을 한다는 가설 하에, 1978년에 규명된 안지오텐신 II의 NMR 구조에 리드 화합물의 구조를 겹쳐 보았다. 그 결과 좀 더 펩타이드에 가까운 구조가 되기 위해서는 리드 컴파운드의 페닐 링에 다른 잔기를 붙여서 확장해야 한다는 결론을 얻게 되었다. 이들은 페닐 링을 카르복실기로 바꿔본 결과 IC50이 1uM로 대폭 낮아짐으로써 이들의 가설이 맞다는 확신을 가지게 되었다. 이들은 여기에 자극받아 다양한 유도체를 합성하여 활성을 확인하였으며, 궁극적으로 안지오텐신 II 수용체 타입 1에 대해서 IC50이 0.012uM로 작용하는 안지오텐신 II 수용체 차단제(Angiotensin II receptor Blocker, ARB)를 얻게 되었다.
![▲그림 3. 좌상) 다케다 (Takeda Pharmaceutical)에서 1982년 특허로 공개된 안지오텐신 II 수용체 저해물질은 [13] IC50 (uM) 기준 15 정도의 낮은 활성을 가진 물질이었다. 이를 리드 컴파운드로 하여 듀퐁 사의 연구원들은 안지오텐신의 구조에 착안하여 페닐 링에서 구조를 확장해야 한다는 가설을 서웠다. 페닐기의 파라 (para) 위치에 카르복시기를 추가하니 IC50 이 10배 감소하였고 (좌하), 이를 시작으로 한 여러 단계의 화합물 최적화를 통하여 안지오텐신 II 수용체 타입 1 을 특이적으로 저해하는 화합물인 로사르탄 (Losartan)을 발굴하게 되었다 (우하) [17].](http://img.etoday.co.kr/pto_db/2019/03/600/20190306091908_1307576_1200_813.png)
▲그림 3. 좌상) 다케다 (Takeda Pharmaceutical)에서 1982년 특허로 공개된 안지오텐신 II 수용체 저해물질은 [13] IC50 (uM) 기준 15 정도의 낮은 활성을 가진 물질이었다. 이를 리드 컴파운드로 하여 듀퐁 사의 연구원들은 안지오텐신의 구조에 착안하여 페닐 링에서 구조를 확장해야 한다는 가설을 서웠다. 페닐기의 파라 (para) 위치에 카르복시기를 추가하니 IC50 이 10배 감소하였고 (좌하), 이를 시작으로 한 여러 단계의 화합물 최적화를 통하여 안지오텐신 II 수용체 타입 1 을 특이적으로 저해하는 화합물인 로사르탄 (Losartan)을 발굴하게 되었다 (우하) [17].
최종적으로 얻어진 화합물은 로사르탄(Losartan)이라고 명명되었다. 1986년 특허가 취득된 이 약물은 1995년 최초의 안지오텐신 II 수용체(안지오텐신 II 수용체 타입 1 특이적) 차단제로 FDA의 승인을 받았으며, 코자(Cozaar)라는 이름으로 시판되게 되었다. 로사르탄의 제네릭은 2010년 처음 판매 허가를 얻었으며, 2016년 현재, 미국에서 9번째로 많이 처방되는 약물이 되었다.
ACE 저해제와 ARB의 개발 과정을 역시 레닌-안지오텐신 시스템에 대한 약 100년에 걸친 연구 끝에 이루어졌으며, 특히 ACE 저해제의 경우는 단백질의 작용 기전 및 구조 정보에 기반하여 디자인된 극히 초창기의 사례라는 것을 눈여겨 볼 필요가 있다. 또한 궁극적으로 로사르탄이 된다.
다음 연재에서는 현재 가장 널리 사용되고 있는 혈압조절제의 클래스인 칼슘 채널 차단제(Calcium Channel Blocker, CCB)의 개발을 낳게 된 연구와 그 개발 과정을 살펴보고자 한다.
참고문헌
1. Tigerstedt, R. and Bergman, P. G. (1898) Niere und kreislauf. Skand. Arch. Physiol. 8, 223–271.; Hall, J. E. (2003). Historical perspective of the renin-angiotensin system. Molecular biotechnology, 24(1), 27-39.
2. Goldblatt, H., Lynch, J., Hanzal, R. F., & Summerville, W. W. (1934). Studies on experimental hypertension: I. The production of persistent elevation of systolic blood pressure by means of renal ischemia. Journal of Experimental Medicine, 59(3), 347-379.
3. Kohlstaedt, K. G., Helmer, O. M., & Page, I. H. (1938). Activation of renin by blood colloids. Proceedings of the Society for Experimental Biology and Medicine, 39(1), 214-215.
4. Munoz, J. M., Braun-Menendez, E., Fasciolo, J. C., & Leloir, L. F. (1939). Hypertensin: the substance causing renal hypertension. Nature, 144(3658), 980.;Page, I. H., & Helmer, O. M. (1940). A crystalline pressor substance (angiotonin) resulting from the reaction between renin and renin-activator. Journal of Experimental Medicine, 71(1), 29-42.
5. Skeggs, L. T., Marsh, W. H., Kahn, J. R., & Shumway, N. P. (1954). The existence of two forms of hypertensin. Journal of Experimental Medicine, 99(3), 275-282.
6. Skeggs, L. T., Lentz, K. E., Kahn, J. R., Shumway, N. P., & Woods, K. R. (1956). The amino acid sequence of hypertensin II. Journal of Experimental Medicine, 104(2), 193-197.
7. Bakhle, Y. S. (1968). Conversion of angiotensin I to angiotensin II by cell-free extracts of dog lung. Nature, 220(5170), 919.
8. Gavras, H., Brunner, H. R., Laragh, J. H., Sealey, J. E., Gavras, I., & Vukovich, R. A. (1974). An angiotensin converting-enzyme inhibitor to identify and treat vasoconstrictor and volume factors in hypertensive patients. New England Journal of Medicine, 291(16), 817-821.
9. Cushman, D. W., & Ondetti, M. A. (1991). History of the design of captopril and related inhibitors of angiotensin converting enzyme. Hypertension, 17(4), 589-592.
10. Byers, L. D., & Wolfenden, R. (1973). Binding of the by-product analog benzylsuccinic acid by carboxypeptidase A. Biochemistry, 12(11), 2070-2078.
11. Ondetti, M. A., Rubin, B., & Cushman, D. W. (1977). Design of specific inhibitors of angiotensin-converting enzyme: new class of orally active antihypertensive agents. Science, 196(4288), 441-444.
12. Consensus Trial Study Group*. (1987). Effects of enalapril on mortality in severe congestive heart failure. New England Journal of Medicine, 316(23), 1429-1435.
13. Pfeffer, M. A., Braunwald, E., Moyé, L. A., Basta, L., Brown Jr, E. J., Cuddy, T. E., ... & Klein, M. (1992). Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction: results of the Survival and Ventricular Enlargement Trial. New England journal of medicine, 327(10), 669-677.
14. Pals, D. T., Masucci, F. D., Denning Jr, G. S., Sipos, F., & Fessler, D. C. (1971). Role of the Pressor Action of Angiotensin IIin Experimental Hypertension. Circulation Research, 29(6), 673-681.
15. Adam, M. (2005). Integrating research and development: the emergence of rational drug design in the pharmaceutical industry. Studies in History and Philosophy of Science Part C: Studies in History and Philosophy of Biological and Biomedical Sciences, 36(3), 513-537.
16. Furukawa Y, Kishimoto S, Nishikawa K. Hypotensive
imidazole-5-acetic acid derivatives . US patent 4,355,040. Issued to Takeda Chemical IndustriesLtd (Osaka, Japan), 1982.
17. Bhardwaj, G. (2006). How the antihypertensive losartan was discovered. Expert opinion on drug discovery, 1(6), 609-618.







