기사본문
[남궁석의 신약연구史]예상못한 부작용 '달라진 운명'
입력 2019-04-04 13:44 수정 2019-04-04 13:44
남궁석 SLMS(Secret Lab of Mad Scientist) 대표
지금까지 우리는 이뇨제, 베타 차단제, 안지오텐신 전환효소 저해제, 안지오텐신 수용체 차단제, 칼슘 채널 차단제에 이르기까지 다양한 고혈압 치료 약물의 개발의 역사를 살펴보았다. 이제부터는 혈압 조절이나 협심증 등의 심혈관질환 치료제를 개발하겠다는 목표로 개발이 시작되었지만, 기대한 것과는 전혀 다른 새로운 클래스의 치료제의 약물들의 개발 과정과 이를 낳게 된 연구를 살펴보도록 하자.
산화질소와 평활근 수축과의 관계
우리는 앞에서 칼슘의 유입에 의해서 평활근 수축이 자극되고, 칼슘 유입을 억제하는 칼슘 채널 차단제에 의해서 평활근 수축을 억제함으로써, 혈압 강하 효과를 얻는 것에 대해서 알아보았다. 평활근의 수축을 매개하는 신호가 칼슘이라면, 그렇다면 평활근의 이완은 어떻게 유도되는가?
평활근의 신호전달 물질로 작용하는 질산화물(Nitric Oxide)과 중간 신호물질인 cGMP(cyclic GMP)의 발견 과정을 알아볼 필요가 있다.
니트로글리세린(Nitroglycerin)은 1847년 이탈리아 화학자인 아스카니오 소베로(Asanio Sobrero, 1812-1888)에 의해서 강력한 폭발성을 가진 물질로 처음 발견되었다. 스웨덴의 알프레드 노벨 (Alfred Nobel, 1833-1896)은 이를 액체 상태로 상업적인 폭발물로 처음 사용하였으나, 불안정성 때문에 잦은 폭발 사고를 일으켰으며 노벨의 남동생은 액체 니트로글리세린의 폭발로 목숨을 잃었다. 노벨은 니트로글리세린을 규조토에 흡착시켜 안정화시킬 수 있다는 것을 발견하였으며, 이렇게 발명된 다이너마이트(Dynamite) 덕에 노벨은 막대한 부를 축적하였다.
한편 이렇게 만들어진 니트로글리세린은 1878년 영국의 의사 윌리엄 머렐(William Murrell, 1853-1912)에 의해서 전혀 다른 용도로 사용될 수 있다는 것을 확인하였다. 즉 소량의 니트로글리세린을 복용함으로써 협심증(angina pectoris)의 심장 통증을 약화시키고 혈압을 내릴 수 있다는 것을 발견한 것이다. 사실 질산화물이 협심증의 통증을 완화시킬 수 있다는 것은 머렐 이전에 1857년 스코틀랜드 에딘버러의 의사인 토마스 라우드 브룬톤(Thomas Lauder Brunton, 1844-1916)가 아밀 니트리트(Amyl Nitrite)가 협심증의 통증을 약화시킬 수 있다는 것이 알려진 것이 먼저이다. 그러나 니트로글리세린 등장 후에는 니트로글리세린은 협심증 치료제로 널리 쓰이게 되었으며, 심지어 니트로글리세린을 처음 폭발물로 사용한 알프레드 노벨 역시 니트로글리세린을 복용하게 되었다.
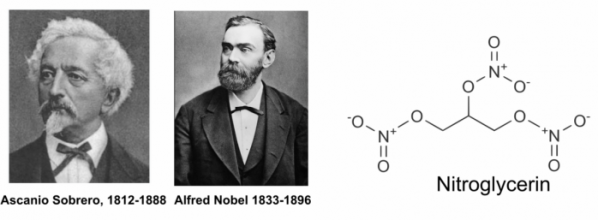
▲그림 1. 니트로글리세린 (Nitroglycerin)을 처음 합성한 아스카니오 소브레로와 이를 폭발물로 상업화한 알프레드 노벨. 니트로글리세린의 협심증 통증 완화 효과는 1878년 영국의 의사 윌리엄 머렐에 의해서 발견되었다. 니트로글리세린은 분해되어 산화질소를 형성하고, 이는 혈관에서 평활근 이완 효과를 가져와서 혈액 유입을 증가시켜서 협심증의 통증을 완화시킨다. 그러나 니트로글리세린의 작동 기전이 정확히 알려진 것은 니트로글리세린이 사용된 이후 약 100여년이 지난 뒤였다.
협심증에 의한 가슴 통증을 완화시킨다는 것은 심장의 혈관을 이완시켜서 확장하는 효과를 의미한다. 그러나 니트로글리세린의 생리적인 활성이 어떻게 기인되는지 알려지기까지는 니트로글리세린을 처음 협심증 치료제로 사용한 이후 100여년이 흐른 뒤에서였다[1]..
이전부터 니트로글리세린 이외에도 여러가지 질산화물이 혈관 평활근(vascular smooth muscle)의 이완을 가져온다는 것이 알려져 있었다. 1979년 연구자들은 소의 동맥 유래 혈관 평활근 세포에 기체 상태의 질산화물(NO)을 가하면 평활근이 수축된다는 것을 발견하였다[2].
일산화질소는 혈관 내피세포(Vascular endothelial cell)에서 아르기닌으로부터 생성되고, 생성된 일산화질소는 혈관 평활근 세포(Vascular Smooth Muscle) 세포로 전달된다. 일산화질소는 GTP를 고리형 GMP(cGMP, cyclic GMP)로 변환하는 구아닐릴 사이클라아제(Guanylyl cyclase)를 활성화하여 평활근 세포 내의 cGMP 농도를 높인다. 이렇게 높아진 cGMP는 cGMP 인산화효소(cGMP kinase)를 활성화하고, cGMP 인산화효소는 마이오신 라이트 체인 탈인산화효소(Myosin Light Chain Phosphatase)를 인산화하여 이를 활성화하고, 결과적으로 혈관의 수축에 필요한 마이오신의 라이트 체인을 탈인산화하여, 액틴-마이오신의 상호작용을 저해한다. 이전 연재에서 칼슘 채널에 의해서 유입된 칼슘에 의해서 마이오신 라이트 체인 인산화효소가 활성화되어 액틴-마이오신의 상호작용이 촉매되어 평활근이 수축된다면, 이는 이의 역반응인 셈이다[3].
그러나 평활근 내에는 cGMP 를 분해하는 인산다이에스라아제(Phosphodiesterase)가 있었고 평활근에 존재하는 일산화질소에 의해서 cGMP가 증가하는 지속 시간에는 한계가 있었다. 이러한 현상은 니트로글리세린을 복용해도 혈관이 잘 이완되지 않는 현상의 원인이라고 생각되었다.
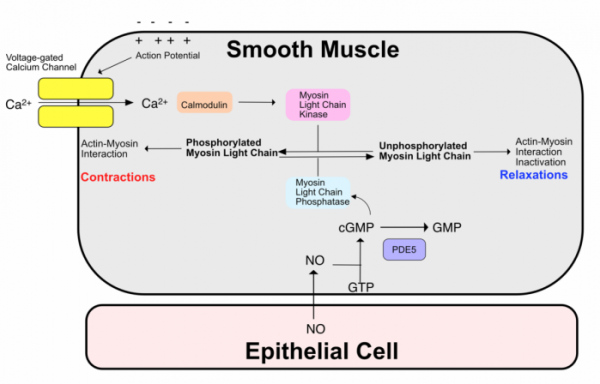
▲그림 2. 혈관 평활근 (Vascular Smooth Muscle)의 근육 수축과 이완 기전. 평활근 생체막을 건너서 형성된 액션 포텐셜에 의해서 칼슘 채널이 개방되고, 유입된 칼슘 이온은 칼모듈린과 결합하여 마이오신 라이트 체인 인산화효소 (Myosin Light Chain Kinase)를 활성화하고, 마이오신 라이트 체인 인산화효소는 마이오신 라이트 체인을 인산화하여 액틴-마이오신의 상호작용을 매개하여 근육 수축을 유발한다. 한편, 혈관내피세포 (Vascular Epithelial Cell)에서 생성되어 평활근 세포로 전달된 질산화물 (NO)는 cGMP 의 수준을 올리는 효소를 활성화하고, 올라간 cGMP 에 의해서 마이오신 라이트 체인 탈인산화효소 (Myosin Light Chain Phosphatase)가 활성화되어 마이오신 라이트 체인의 인산기가 제거되고, 액틴-마이오신의 상호작용이 더 이상 이루어지지 않게 되므로 평활근은 위축된다. 이때 cGMP 신호는 이를 분해하는 PDE5 에 의해서 분해된다. 만약 PDE5 가 억제될 경우 평활근 내에 cGMP 수준이 유지되므로, 계속하여 마이오신 라이트 체인 탈인산화효소의 활성이 유지되고 근 이완은 계속된다.
Phosphodiesterase 저해 물질의 발견
이렇게 산화질소와 평활근 수축에 대한 기전이 밝혀지자 자연스럽게 많은 제약회사들은 cGMP의 분해를 촉진하는 인산다이에스테라아제(Phosphodiesterase)를 저해하면 cGMP의 분해를 억제할 수 있고, 따라서 산화질소에 의한 평활근 이완의 지속 시간을 높임으로써 혈액 순환을 도울 수 있을 것이라는 가설하에 인산다이에스테라아제에 대한 저해물질을 찾으려고 했다. 즉, 관상동맥의 평활근을 이완시킴으로써 심장에 더 많은 피를 공급하고, 이를 이용하여 협심증 등의 증상을 개선하고 혈압 강하 효과를 가진 새로운 약물을 발굴할 수 있을 것이라는 것이 연구의 기본 가설이었다[4].
해당 프로젝트가 시작되던 1980년대 중반에 이미 여러 종류의 인산다이에스테라아제가 존재한다는 것이 알려져 있었다. 이중 PDE1, PDE2, PDE3 은 사이클릭 AMP(cAMP)와 cGMP를 동시에 분해하고, PDE4 의 경우에는 cAMP에 특이적으로 반응한다. 그러나 PDE5 라는 인산다이에스타라아제의 경우 cGMP를 특이적으로 분해했다. 그리고 혈관 평활근 세포에도 존재하고 있었으므로 화이자(Pfizer) 영국 연구소는 PDE5를 타깃으로 이를 저해하는 물질을 발굴코자 하였다.
이들의 연구 이전에 알려진 인산다이에스테라아제 저해제는 1970년대에 항 알러지 화합물로 개발된 화합물인 구아닌 유사체인 자프리니스트(Zaprinast)라는 물질이 있었다[5]. 이 물질은 예상대로 동물에서 혈관 확장효과와 혈압 강하효과를 보였다. 그러나 이 물질은 여러 종류의 PDE를 동시에 저해하였고, 이의 저해 활성도 그리 강하지 못했다[6]. 화이자 연구진들은 자프리니스트를 리드로 삼아, PDE5 를 특이적으로 강하게 저해하는 화합물을 찾으려고 했다.
자프리니스트의 변이체 중에서 퓨린 기의 질소에 메틸기를 결합시키고 프로필에폭시를 에틸에폭시로 바꾼 화합물(pyrazolo[4,3-d]pyrimidinin-7-one])은 다른 인산다이에스테라아제에 비해서 PDE5를 10배 이상 강하게 저해하였다. 그러나 아직까지 PDE5에 대한 IC50은 300nM 정도로 충분하지 못하였다.
이들은 cGMP와 화합물의 분자 구조를 비교하였을때 cGMP의 리보스를 좀 더 모방하기 위해서는 퓨린 기의 3번 위치의 메틸기를 좀 더 덩치가 큰 잔기로 변경해야 할 것이라는 가설하여 3번 위치의 메틸기를 n-프로필기로 바꾸어 보니, IC50 은 27nM로 훨씬 강한 저해 활성을 보이게 되었다.
추가적으로 2-에톡시페닐기의 5’ 위치에 잔기를 추가하여 원래의 기질인 cGMP의 인산에 해당하는 부분을 넣는 여러가지 변형을 테스트해보았다. 이 위치에 설폰아미드(Sulfolamide) 기를 넣어보니 약물의 용해도가 개선되고, 저해 활성이 좀 더 증가하여 3.6nM의 IC50을 가지는 화합물이 탄생하게 되었다[7]. 이 UK-92480 이라는 코드네임을 가진 화합물은 1989년 완성되었고, 실데나필(Sildernafil)이라는 이름으로 1991년 협심증 및 혈압저하제로써 본격적인 임상 개발에 돌입하였다. 그러나 이의 임상 개발 과정에서는 개발 초기에는 예상하지 못했던 일이 발생하기 시작하였다.
신통치 않은 기대했던 효과와 예상치 못한 부작용
1991년부터 시작된 임상 1상에서 실데나필은 기대한 대로 어느정도의 혈관 확장 효과와 혈압 강하 효과를 나타냈다. 그러나 그 효과는 기존에 사용하던 니트로글리세린의 효과에 비해서 그닥 뛰어나지 못했다[8]. 또한 니트로글리세린과 실데나필은 동시에 사용하였을때 지나치게 혈압이 낮아지는 현상이 발생하였다[9]. 협심증 환자들에서 니트로글리세린이 흔히 사용된다는 것을 생각할 때 니트로글리세린과 함께 실데나필은 사용하면 혈압 강하 효과가 지나치게 일어난다는 것은 그다지 좋지 않은 일이었다. 또한 실데나필의 반감기는 비교적 짧았고, 이를 극복하기 위해서는 하루 3회 복용해야 했다는 것도 문제로 작용했다.
그런데 여기서 환자의 부작용 사례가 보고되었다. 환자들이 10일 이상 실데나필을 복용하였을 때몇몇 환자들이 성기의 발기가 좀 더 자주 일어나고, 약을 복용하지 않았을 때보다 길게 지속된다는 것을 보고하였다. 연구진들은 처음에는 이러한 부작용에는 크게 주의를 기울이지 않았다. 그 이유는 처음에 보고된 해당 부작용은 10일 이상 실데나필을 하루 3회 복용했을때만 나타났고, 처음의 단일 복용량에 의한 임상시험에서는 보고되지 않았기 때문이다.
그럼에도 불구하고 이러한 별난 부작용은 연구자들의 관심을 끌었고, 이러한 부작용의 기전을 해명하기 위한 연구가 실시되었다. 만약 PDE5의 억제에 의해서 발기가 유지된다면, 남성기의 발기를 가능케 하는 해면체(Corpus cavernosum)의 평활근에도 PDE5가 많이 발현되어야 할 것이다. 예상대로 남성기의 해면체 조직에서 PDE5이 많이 존재하는 것이 확인되었다[10]..
결국 이들은 기존에는 잘 알려지지 않은 남성기의 발기 기전에 대한 발견을 하게 된 셈이다. 성적 자극을 받게 되면 해면체의 신경 세포와 내피세포는 산화질소를 방출하게 되고, 방출된 산화질소는 혈관 평활근세포와 마찬가지로 cGMP의 합성을 유도하여 평활근의 이완을 야기하고 혈액의 유입을 증가시킨다. PDE5 가 억제되면 cGMP의 분해가 억제되어 평활근의 이완이 지속되어 해면체로의 혈액 유입 자체가 지속될 것이고, 이는 발기 지속시간 증가를 유도할 것이다.
이들은 이러한 증거에 힘입어 애초에 협심증 및 고혈압 치료제로 개발되었던 실데나필의 개발 방향을 발기부전 치료제로 바꾸기로 계획하였다. 그러나 기존에 한번도 연구된 적이 없던 발기부전 치료제의 개발을 위해서는 여러가지 요소가 새롭게 개발되어야만 했다. 가령 어떻게 발기부전 치료제의 약효를 측정할 것인가?
이리하여 처음 협심증 치료제 및 고혈압 치료제로 개발되었던 실데나필이라는 물질의 운명은 크게 달라지게 된다. 다음 연재에서는 실데나필의 임상 개발과정과 사용 승인, 그리고 비슷하게 같은 타깃을 저해하는 PDE5 저해물질인 타다라필 (Tadarafil)의 개발 과정 및 발기부전 치료제라는 기존에 없었던 새로운 클래스의 약물 시장의 형성에 대해서 알아보도록 하자.
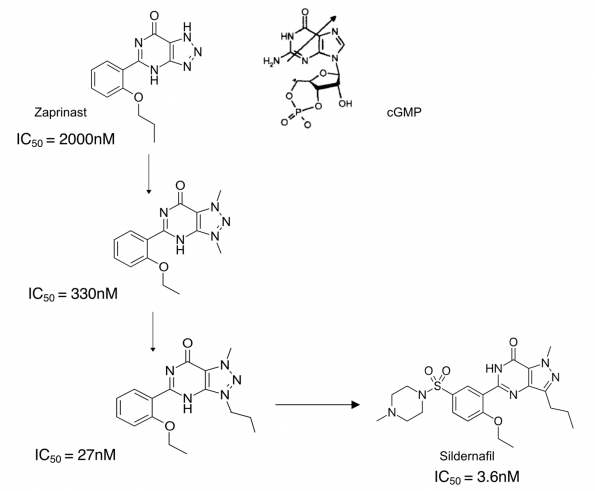
▲그림 3. 실데나필 (Sildernafil) 이라는 이름이 된 PDE5 저해제의 개발 과정. 자프리나스트 (Zaprinast)라는 기존에 알려진 GMP 유사체인 PDE 저해제는 선택성이 떨어지고, 저해 활성도 약한 물질이었다. 이의 퓨린 기에 메틸기를 붙이고, 프로필에폭시를 에틸에폭시로 바꾸자 PDE5에 대한 저해 활성이 강해졌다. 여기서 3번 위치의 메틸기 위치에 원래 리보스 링이 존재한다는 것에 착안하여 이를 좀 더 덩치가 큰 프로필기로 바꾸자 저해 활성이 다시 10배 이상 강해졌다. 여기에 설폰아미드 기가 추가된 것이 실데나필이 된다.
참고문헌
1. Yetik-Anacak, G., & Catravas, J. D. (2006). Nitric oxide and the endothelium: history and impact on cardiovascular disease. Vascular pharmacology, 45(5), 268-276.
2. Gruetter, C. A., Barry, B. K., McNamara, D. B., Gruetter, D. Y., Kadowitz, P. J., & Ignarro, L. (1979). Relaxation of bovine coronary artery and activation of coronary arterial guanylate cyclase by nitric oxide, nitroprusside and a carcinogenic nitrosoamine. Journal of cyclic nucleotide research, 5(3), 211-224.
3. Carvajal, J. A., Germain, A. M., Huidobro‐Toro, J. P., & Weiner, C. P. (2000). Molecular mechanism of cGMP‐mediated smooth muscle relaxation. Journal of cellular physiology, 184(3), 409-420.
4. Osterloh, I. H. (2004). The discovery and development of Viagra®(sildenafil citrate). In Sildenafil (pp. 1-13). Birkhäuser, Basel.
5. Holland, A., Jackson, D., Chaplen, P., Lunt, E., Marshall, S., Pain, D., & Wooldridge, K. (1975). Antiallergic activity of 8-azapurin-6-ones with heterocyclic 2-substituents. EUROPEAN JOURNAL OF MEDICINAL CHEMISTRY, 10(5), 447-449.
6. Komas, N., Lugnier, C., & Stoclet, J. C. (1991). Endothelium‐dependent and independent relaxation of the rat aorta by cyclic nucleotide phosphodiesterase inhibitors. British journal of pharmacology, 104(2), 495-503.
7. Terrett, N. K., Bell, A. S., Brown, D., & Ellis, P. (1996). Sildenafil (VIAGRATM), a potent and selective inhibitor of type 5 cGMP phosphodiesterase with utility for the treatment of male erectile dysfunction. Bioorganic & medicinal chemistry letters, 6(15), 1819-1824.
8. Jackson, G., Benjamin, N., Jackson, N., & Allen, M. J. (1999). Effects of sildenafil citrate on human hemodynamics. The American journal of cardiology, 83(5), 13-20.
9. Webb, D. J., Freestone, S., Allen, M. J., & Muirhead, G. J. (1999). Sildenafil citrate and blood-pressure–lowering drugs: results of drug interaction studies with an organic nitrate and a calcium antagonist. The American journal of cardiology, 83(5), 21-28.
10. Ballard, S. A., Gingell, C. J., Tang, K. I. M., Turner, L. A., Price, M. E., & Naylor, A. M. (1998). Effects of sildenafil on the relaxation of human corpus cavernosum tissue in vitro and on the activities of cyclic nucleotide phosphodiesterase isozymes. The Journal of urology, 159(6), 2164-2171.







