기사본문
'럭스터나' 이후 희귀 안과질환 '유전자치료제' 개발↑
입력 2019-07-16 08:11 수정 2019-07-16 09:38
바이오스펙테이터 조정민 기자
유전성 안과질환을 표적한 유전자 치료제 개발이 속도를 내고 있다. 지난 2017년 미국 식품의약국(FDA)이 스파크 테라퓨틱스의 희귀유전 망막질환 치료제 ‘럭스터나(Luxturna)’를 허가한 이후 연구개발이 가속화되는 분위기다.
유전자 치료제의 표적인 유전성 망막질환(Inherited retinal dystrophies; IRDs)은 유전자 결함에 따른 진행성 망막 변성의 희귀질환을 모두 포함한다. IRD는 200개 이상의 유전자 결함과 관련이 있다고 알려져 있다.
16일 범부처신약개발사업단에 따르면 현재 안과질환을 대상으로 임상단계에 진입한 유전자 치료제 파이프라인은 총 25개로, 망막색소변성증 및 LCD 뿐만 아니라 노인성황반변성(AMD), 포도막 흑색종 등 다양한 안과질환을 적응증으로 개발되고 있다. 범부처신약개발사업단은 'Nature Reviews of Drug Discovery' 2019년 6월호에 게재된 'Gene therapies in ophthalmic disease'을 바탕으로 시장 현황을 분석했다.
이선경 선임연구원은 "대부분의 파이프라인은 변형된 유전자를 복구하는 방향으로 개발되고 있으며 주요 타깃 유전자는 REP1, CNGA, RPE65, RS1, RPGR 등”이라고 말했다.
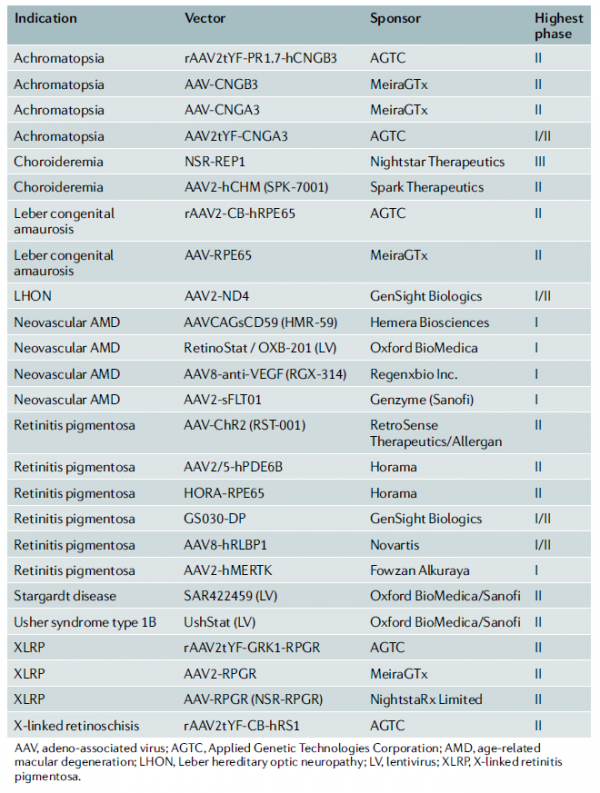
▲안구질환 유전자치료제 임상 상 파이프라인 현황
가장 주목할 만한 파이프라인으로는 치료 단백질 유전자를 삽입해 신생혈관 생성과 세포사멸을 억제하는 기전의 AMD 치료제와 레트로센스 테라퓨틱스가 개발 중인 망막색소상피 치료 후보물질 ‘RST-001’을 꼽았다. RST-001은 channelrhodopsin 2를 전달함으로써 빛에 대한 민감도가 낮은 세포에 광과민성을 부여한다.
임상3상을 진행 중인 것으로는 나이트스타(NightStar)의 NSR-REP1으로 “빠른 시일 내에 시판 승인이 기대된다”고 전망했다. 해당 후보물질은 눈 안에 REP1을 생성시키기 위해 재조합 인간 cDNA를 탑재한 AAV2 벡터로 2020년 1분기까지 140여명 규모의 환자 모집완료를 목표로 임상을 진행 중이다.
그는 “유전성 망막질환은 유전자 치료제를 적용하기에 매우 이상적인 질환이다. 질병을 유발하는 원인 유전자를 명확하게 알고 있을 뿐 아니라 안구가 면역 특권(immune privilege) 기관이기 때문에 면역반응에서 자유롭기 때문”이라고 설명했다. 현재까지 진행된 임상시험 결과, 유전자를 전달하는데 사용하는 아데노 부속 바이러스(AAV)와 렌티바이러스 벡터(lentivirus vectors) 투여 후 부작용이나 면역반응이 일어난 사례가 보고된 바 없다.
IRD에서 가장 흔한 질환은 망막색소변성증, 맥락막 결손, 레베르시신경병증, 레버선천성흑암시, 색맹과 X-연관 망막층간분리증 등으로 현재 개발 되는 대부분의 안과 유전자 치료제는 해당 질환을 대상으로 하고 있다고 설명했다.
IRD의 대부분은 유전자 결함이 망막표피세포, 망막색소상피(retinal pigment epithelium; RPE), 맥락막모세혈관층(choriocapillaris) 등에 영향을 미치며 이러한 경우에는 바이러스 전달체가 망막하 공간에 전달돼야 한다. 신경절세포를 표적하는 레버씨 시신경 위축증의 경우 유리체강으로의 전달이 필요하다.
이 선임연구원은 유전자 치료제가 임상 성공과 시판 승인이라는 큰 장벽을 넘었음에도 불구하고 여전히 생산과 임상 디자인, 장기 안전성 및 상업화 전략 등의 해결 문제가 남아있다고 지적하면서 이러한 한계를 극복하기 위해서는 CQA(Critical Quality Attributes)의 완벽한 통제와 세밀한 임상연구 개발 전략 수립, 장기 안전성 확인과 함께 임상환자의 추적 데이터 확보에 대한 계획 수립 등이 신약 개발 및 상업화 단계에서 중요 요소로 고려돼야 한다고 덧붙였다.