기사본문
팜캐드, 'AI 기반’ 유효물질(hit) 발굴 플랫폼 런칭
입력 2020-02-05 14:01 수정 2020-02-05 15:28
바이오스펙테이터 서윤석 기자

▲발표중인 우상욱 대표(바이오스펙테이터 촬영)
AI 기반 신약개발 기업 팜캐드(Pharmcadd)가 구조가 밝혀지지 않은 단백질의 구조를 아미노산 서열만 가지고 예측하고 약물로 사용될 저분자화합물과 상호작용을 분석해 약물을 디자인하는 AI기반 플랫폼 ‘파뮬레이터 버전1.0(Pharmulator Ver1.0)’을 내놨다. 팜캐드는 국제 단백질 구조 예측대회인 CASP14에 참가해 파뮬레이터의 구조 예측 정확성을 선보일 계획이다.
팜캐드는 지난 4일 서울 삼성동 그랜드인터콘티넨탈 파르나스호텔에서 ‘파뮬레이터 버전1.0 런칭 행사’를 가졌다. 발표자로 나선 우상욱 팜캐드 공동대표는 인공지능(AI)의 딥러닝 알고리즘, 분자동역학 시뮬레이션(molecular dynamics(MD) simulation), 양자계산을 활용해 개발한 자체 AI 약물 디자인(drug design) 플랫폼인 파뮬레이터 버전 1.0과 앞으로의 계획에 대해 발표했다.
우 대표는 팜캐드의 핵심기술로 “단백질의 3D 구조분석기술, MD 기술, 양자계산을 이용한 저분자화합물 기준값(parameter) 추출 기술, 이를 망라한 약물 디자인 기술”이라고 말했다.
발표에 따르면 팜캐드가 개발한 파뮬레이터는 단백질의 아미노산 서열만으로 단백질 3차 구조를 2~3분 내에 예측한다. 신약 개발에서 난제로 여겨지는 약물후보와 타깃 단백질의 결합을 예측해 신약 개발의 성공률을 개선하고, 약물 개발에 필요한 시간과 비용을 절감할 수 있다. 우 대표는 “기존에 있는 모든 데이터베이스(database, DB)의 아미노산을 분석해 부피, 전기음성도, 수소친화도 등의 특징을 7개로 카테고리화해 AI에 트레이닝 시켰다”며 ”5가지 각도를 지정해 분석함으로써 단백질, 특히 막 단백질의 구조를 정확하게 분석할 수 있었다”고 말했다.
팜캐드와 다른 AI기반 회사들과의 차이점은 무엇일까? 우 대표는 “AI가 유효물질(hit compound)를 골라내는 것만으로도 신약 발굴(drug discovery)에 큰 역할을 하는 것이라고 생각한다”며 “기존 AI를 표방하는 회사와는 다르게 물리학적, 화학적 방법으로 양자(quantum) 수준까지 가는 보다 정교한 기술을 가지고 있다는 것이 차별점”이라고 말했다.
유효물질은 화합물이 타깃 유기체 또는 단백질에 선택적으로 시험관내(in vitro) 활성을 보이는 것을 의미한다. 유효물질(hit compound)탐색-선도물질(lead compound) 개발-약물 후보물질(drug candidate)로 이루어지는 신약 발굴에서 첫 단계다.
우 대표는 “우리 팜캐드는 다른 단백질을 제외하고 오직 막 단백질(membrane protein)에만 집중하고 있다”며 “막 단백질의 많은 단백질이 약물의 타깃이 되기 때문”이라고 말했다. “미국 식품의약국(FDA)에서 승인받은 약물의 54%가 막단백질이 타깃이다”고 우 대표는 덧붙였다.
팜캐드는 파뮬레이터의 정확성을 높이기 위해 집중하고 있다. 팜캐드는 단백질-약물 결합을 다이나믹하게 분석하는 분자동역학(molecular dynamics, MD) 기술과 적합한 약물을 선택하기 위한 저분자 화합물 기준값을 기반으로 정확성을 높이고 있다. 약 16만 종류의 단백질 정보를 특성에 따라 카테고리화하고, 약과 유사한 특성을 지닌 화합물 데이터베이스인 CHEMBL에서 고른 약 10만개의 저분자 화합물에 대한 기준값을 파뮬레이터에 추가했다. 우 대표는 “저분자 화합물의 기준값을 매번 정확하게 설정하기가 쉽지 않다”며 “10만개의 저분자 화합물을 전부 분석해 팜캐드만의 기준값을 개발하고 있다”고 말했다.
팜캐드는 파뮬레이터 버전1.0의 정확성을 최대한 높여 올해 개최되는 CASP14 대회에 출전해 성능을 검증할 예정이다. CASP14(critical assessment of structure prediction 14)는 기존에 밝혀지지 않은 단백질 구조를 예측해 검증하는 세계 대회로 2년마다 개최된다. 권태현 팜캐드 공동대표는 “CASP13에 참가해 우승한 구글의 알파 폴더(alpha folder)와 경쟁하려 한다”며 포부를 밝혔다. 구글의 알파폴더는 2018년 CASP13에 참가해 43개의 단백질 구조 중 25개를 맞히며 98개팀 중 우승을 했다. 2등을 차지한 팀은 단 3개의 단백질 구조를 예측했다.
우 대표는 “파뮬레이터 버전1.0은 단백질과 약물을 1:1로만 비교분석이 가능했지만, 올해 후반 다대다 비교분석, 독성 유무 분석, 네트워크 이론을 기반으로 분석이 가능한 파밀레이터 버전2.0을 개발할 계획”이라고 말했다.
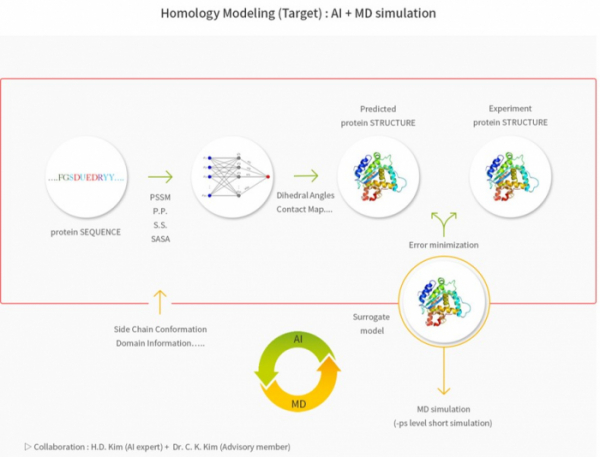
▲팜캐드의 'AI+분자동역학' 단백질 구조 예측 모식도(팜캐드 홈페이지 참조)
팜캐드는 독자적인 신약 후보물질도 개발 중이다. 팜캐드는 혈액응고제 와파린(wafarin)을 대체할 신약을 개발 중이다. 와파린은 비타민K(Vitamin K)를 타깃하는 응고제지만, 약과 음식간 상호작용 등으로 인해 약효에 제한이 있고, 출혈 등의 부작용 우려가 있어 사용하기 어려운 약물이다. 팜캐드는 이런 문제점을 해결하기 위해 2018년 블러드에 개제한 논문 결과를 기반으로 NOAC(Novel oral anticoagulant) 약물을 개발하고 있다. 추가로 다발성 경화증에 대한 치료제 후보물질로 막단백질인 S1PR을 타깃하는 약물도 개발하고 있다.
팜캐드는 사업모델로 신약 연구개발과 신약 후보물질 기술이전을 꼽았다. 권 대표는 “먼저 와파린 NOAC을 직접 개발을 시작했고, 오는 6-7월경 미국 보스턴에 연구개발을 위한 R&D센터를 구축 예정이다”며 “여러 제약사와 협업해 마일스톤과 로열티로 수익을 창출하는 것이 목표로 현재 몇몇 제약사와는 계약이 진행 중에 있다”고 말했다.
팜캐드는 2020년의 목표로 자체 약물 개발, 파뮬레이션 시스템 업그레이드, 학회참가를 들었다. 우 대표는 “2020년에는 파뮬레이션 시스템2.0 개발, 자체 약물 2개 개발, 파뮬레이션 시스템 정확성을 검증하기 위해 CASP14 대회에 출전, 이탈리아 밀라노에서 7월에 개최될 혈액 암학회에서 파뮬레이터로 구조 분석한 연구 결과를 발표할 것”이라고 말했다.







