기사본문
이뮤노메딕스, TNBC 新ADC '트로델비' "표준요법 가능성"
입력 2020-07-08 15:25 수정 2020-07-09 10:54
바이오스펙테이터 김성민 기자
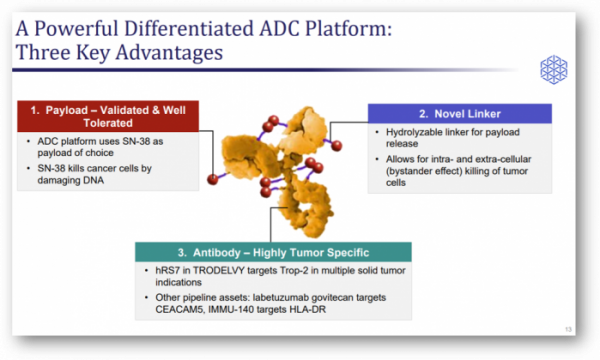
▲트로델비의 약물 구조, 회사 발표자료
치료옵션이 제한적이고, 예후가 나쁜 악성 고형암종 전이성 삼중음성유방암(mTNBC) 치료제 분야에 게임체인저 약물이 등장했다. 이뮤노메딕스(Immunomedics)의 ADC 약물 ‘트로델비(Trodelvy, sacituzumab govitecan)’가 mTNBC 대상 최신 임상3상에서 표준 화학요법 대비 병기가 진행되거나 환자가 사망할 위험을 59% 낮춘 긍정적인 결과를 발표했다(p< 0.0001).
회사에 따르면 mTNBC에서 임상적 유효성을 확인한 첫 ADC 약물이라는 설명이다.
트로델비는 국내에서 삼성바이오로직스가 수주한 임상개발용 약물 중 제품으로 시판허가를 받은 첫 약물이다. 이뮤노메딕스는 올해 4월 삼성바이오로직스와의 트로델비 항체(hRS7) 생산 계약규모를 1500억원 늘렸다. 트로델비는 최대 매출액이 30억달러에 이를 것으로 예측되는 블록버스터 제품으로 꼽힌다.
트로델비는 지난 4월 단일군, 다기관 임상2상에서 확인한 우수한 약물 반응률 결과를 바탕으로 미국 식품의약국(FDA)으로부터 가속승인을 받았다. 임상2상에서 mTNBC 환자 108명을 대상으로 트로델비를 투여했을 때 전체반응률(ORR)은 33.3%(33/108명)를 확인했다. 이뮤노메딕스는 FDA 특별시험계획(SPA)를 통해 확증 임상3상을 디자인해 mTNBC 환자 500명을 대상으로 진행했고, 이번 결과를 통해 트로델비 입지를 더욱 강화한 것이다.... <계속>







