기사본문
지투지바이오, 서방형 '기술장벽-시장수요' "갭 채운다"
입력 2021-02-17 09:31 수정 2021-02-17 09:31
바이오스펙테이터 서윤석 기자

현재까지 미국 식품의약국(FDA)에서 승인받은 서방형 약물 수는 10개 남짓이다. 대표적인 약물이 노바티스 말단비대증 치료제 ‘산도스타틴(Sandostatin LAR)’과 얀센의 조현병 치료제 ‘인베가(Invega Sustenna)’다. 2019년 기준으로 산도스타틴이 약 15억8500만달러, 인베가가 약 33억달러의 매출을 올리는 블럭버스터 약물이다.
실제로 노바티스의 산도스타틴은 2017년 미국 특허가 만료됐지만, 제네릭이 시판되지 않고 있다. 수년 전부터 테바, 선파마 등 글로벌제약사들이 경쟁적으로 산도스타틴 개발에 뛰어들었지만 미국식품의약국에 임상시험계획(IND)조차 시도하지 못한 상태다.
왜 이런 일이 발생하는 것일까? 지속형 의약품을 만드는 것이 언뜻보면 쉬워보이지면 기술적 장벽이 매우 높기 때문이다. 이희용 지투지바이오(G2G Bio) 대표는 “일반적인 특허만료 의약품의 경우 제네릭이 등장하면서 빠르면 한달에서 일년 사이 약가가 절반이상 떨어지는 것이 보통이지만, 미립구 기반 약물은 진입장벽이 높아 제네릭이 등장하기 어렵다”고 말했다.
이 대표는 “연구수준에서 소량 제조는 쉬운편이나, 약효가 일정한 후보제형 도출과 제조시 재현성을 갖춘 대량생산은 또다른 문제로 가장 큰 기술적 난관”이라며 “미국, 유럽의 글로벌 제약사들도 약물방출 조절 실패로 약동학(PK)을 구현하지 못하거나 대량생산 공정개발에 실패해 제품 개발을 중단한 사례가 많다”고 설명했다.
하지만 복용의 편의성 때문에 시장의 수요는 더 커지고 있다. 시장조사기관 이벨류에이트파마(evaluatepharma)에 따르면 얀센(Janssen)의 서방형 조현병 치료제 ‘인베가(Invega)’의 경우 2009년 4억3000만달러 규모의 시장이 2018년 31억달러 규모로 커졌다. 전체 조현병 치료제 시장에서 2009년 92% 비중을 차지하던 경구용 약물이 2018년 7%로 감소함과 동시에, 8%에 불과하던 1개월 주사제형 비중이 78%로 증가했다. 3개월 주사제를 합치면 서방형 주사제의 전체 매출 비중은 93%에 달한다.
지속형 의약품 개발의 높은 기술적 장벽과 커지는 시장의 수요 사이의 갭을 채우겠다는 것이 지투자바이오의 목표다. 2017년 설립된 지투지바이오는 펩트론에서 연구사업개발을 총괄한 바 있는 이희용 대표와 펩트론, 동국제약, 대웅제약에서 서방형 주사제 개발을 총괄했던 설은영 연구소장 등의 인력구성을 가지고 있다. 모두 20여년 이상 약효지속성 신약을 개발, 기술이전 및 상업화한 경험을 가진 전문가다. 여기에 다양한 서방형 약물을 개발해 시판한 경험이 있는 알커미스(Alkermes) 출신의 레이몬드 바투스(Raymond Bartus) 박사와 마크 트레이시(Mark Tracy) 박사를 지난해 과학자문위(SAB) 위원으로 영입했다.
지투지바이오는 1회 투여로 1주~1개월간 약효가 지속되는 치매, 당뇨병, 비마약성 수술후 통증치료제 등의 개량신약을 개발하고 있다. 약효가 이미 검증된 기존 약물을 생분해성 고분자를 이용해 균일한 미립구로 제조한다. 이렇게 제조한 미립구의 크기와 생분해성 고분자 조성에 따라 체내에서 방출되는 기간을 조절할 수 있다는 설명이다.
이 대표는 “현재까지 미국 식품의약국(FDA)에 승인받은 서방형 의약품은 약 10여개뿐”이라며 “이전에 상업화에 성공한 연구경험을 기반으로 생분해성 고분자를 이용한 미립구로 약물을 개발해 약물을 장기간 투여하거나 복약이 어려운 환자들에게 제공할 것”이라고 말했다.
미립구 기반 서방형 의약품의 경우 가장 큰 어려움은 균일한 품질로 대량생산하는 것인데, 지투지바이오는 대량생산, 높은 수율, 균일한 품질 및 재현성을 모두 확보했다는 설명이다. 이 대표는 “자체개발한 제조공정을 바탕으로 대량생산이 가능하고 생산시간을 경쟁사보다 단축시켰을 뿐 아니라, 충전공정까지 전부 무균상태에서 진행할 수 있다”고 자사 기술의 차별성을 설명했다.
바이오스펙테이터는 지투지바이오의 서방형 약물기술과 파이프라인 개발현황에 대해 정리했다.
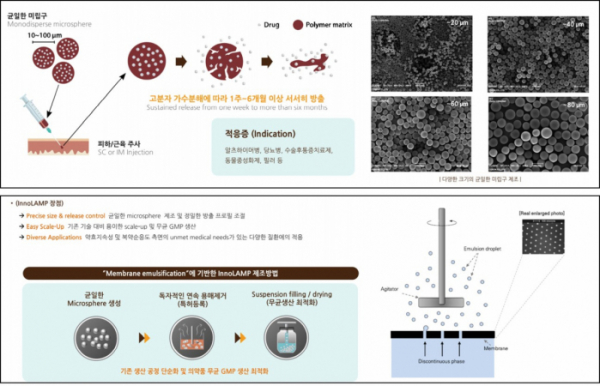
▲지투지바이오의 미립구 서방형 약물 제조법(지투지바이오 발표자료 참조)
◆ 품질, 수율, 제조시간 3가지를 모두 잡은 ‘이노램프(InnoLAMP) 기술’
지투지바이오의 핵심 기술인 ‘이노램프(innovative long acting microparticle, InnoLAMP)’는 약효물질을 생분해성 고분자와 섞어 균일한 크기의 미립구를 제조하는 기술이다. 미립구는 생분해성 고분자를 구성하는 성분의 비율에 따라 체내에서 약효성분이 녹아나오는 속도를 조절함으로써, 1주일에서 6개월 이상 약효를 유지하도록 한다.
미립구를 이용한 서방형 약물의 경우 제조과정을 ①균일한 미립구 제조 ②용매제거 과정 ③무균상태 등으로 구분할 수 있다. 지투지바이오는 독자적인 방법으로 기존 미립구를 이용한 서방형 의약품 제조과정의 한계를 극복했다는 점에서 기존 방식과 차별화된다. 먼저, 지투지바이오는 스테인리스 재질의 판에 균일한 크기의 구멍이 나있는 장비를 구축했다. 여기에 약물과 생분해성 고분자를 잘 섞어 통과시킴으로써 균일한 품질의 미립구를 제조하는 기술을 확보했다. 이를 통해 생산량을 높이고 공정단계를 단축시켰다.
이 대표는 “균일한 품질의 미립구 제조를 위해 영국 마이크로포어 테크놀로지(Micropore Technologies)와 독점계약을 통해 멤브레인 장비를 도입했다“며 “독자적인 기술로 미립구의 높은 수율을 확보하고 시간당 수 kg까지도 신속한 생산이 가능해 대량으로 제조가 가능하다”고 말했다.
기존의 방식은 약물과 고분자를 에멀전(Emulsion) 형태로 만든 후 용매 제거, 회수, 건조, 파쇄, 충전 등의 복잡한 공정을 거친다. 기존 에멀전 제조법은 높은 속도로 물질을 섞는 고속교반을 이용하기 때문에 미립구 입자가 균일하지 않아 필터링과 회수과정을 거쳐야 하며, 용매 제거과정에서 일정한 약동학(PK)을 가진 약물 생산이 어려워 생산성이 낮았다. 또, 주사제형으로 만들기 위해 무균시설에서 건조, 파쇄 후 분말상태로 용기(vial)에 충전하는 과정도 어려웠다. 이에 반해 지투지바이오는 이노램프기술로 대량생산한 미립구를 동결건조 방식을 통해 수월하게 용기에 충전할 수 있는 차별성을 가진다.
이 대표는 “여러 단계를 거쳐 균일한 크기의 미립구를 골라낸 후에도 마지막 제형 충전단계가 만만치 않다. 공정과정이 복잡하고 길수록 오염 확률이 높고 시간과 비용이 많이 들게 된다"며 "자체 GMP 시설 구축이 필요한 만큼 생산비용도 높다”고 일반적인 미립구 제조공정의 한계에 대해 설명했다.
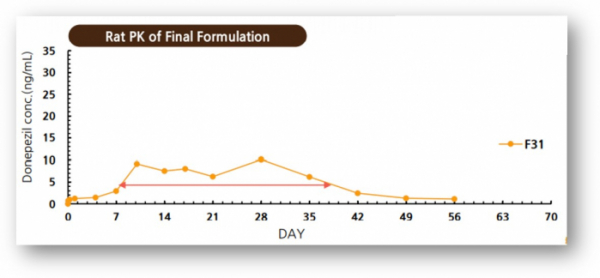
▲GB-5001의 전임상 PK 결과(지투지바이오 발표자료 참조)
◆ 1개월 지속형 ‘도네페질’..올해 1상 완료 목표
우선적으로 주력하고 있는 분야는 매일 약을 복용해야 하는 치매 시장이다. 노인환자가 많은 치매의 경우 규칙적인 약물 복용이 어려운 경우가 많다. 지투지바이오는 치매 치료제로 사용되는 ‘도네페질‘을 월1회 주사제형으로 개발해 복약순응도를 높이겠다는 것. 이를 통해 기존 경구용이나 패치용으로 개발된 도네페질에서 나타나는 위장관, 피부반응 등의 부작용 발생을 피하겠단 전략이다.
지투지바이오는 치매 치료제 후보물질 ‘GB-5001(donepezil)’을 월1회 주사제형으로 개발 중이며, 현재 캐나다에서 임상 1상을 준비하고 있으며 올해 완료가 목표다.
이 대표는 “임상 1상을 완료하고 기술이전을 추진할 예정”이라며 “도네페질 같이 약효가 이미 인정된 경우는 임상 1상에서 안전성과 적정 용량을 확인하고 바로 허가 임상을 진행할 수 있다"고 말했다. 이어 “허가임상의 경우는 임상제조시설과 상업화 제조시설이 같아야 하기 때문에, 글로벌 CMO업체를 통해 진행할 계획"이라고 말했다.
또다른 치매 치료제 후보물질은 ‘GB-5112’로 리바스티그민(rivastigmine)을 서방형으로 제조한 약물이다. 라바스티그민은 AChE와 BuChE를 저해하는 기전을 가지고 있어, AChE 저해제인 도네페질과는 다른 기전을 가진다. 이 때문인지, 리바스티그민은 도네페질로 치료효과가 없는 치매환자의 54.5%, 도네페질의 부작용으로 치료를 중단한 치매환자의 74.4%에서 효과가 있다고 알려져있다.
또, 도네페질등 다른 치료제에서는 개선하지 못하는 치매 환자의 불면증, 식욕변화, 불안감 등의신경정신질환을 개선하는 효과가 있다고 알려져있다. 지투지바이오는 현재 전임상 단계에서 제형 최적화와 스케일업(scale-up)을 진행하고 있다.
이외에도 지투지바이오는 비마약성 수술후 통증치료제, 당뇨병 치료제, 반려동물 중성화제 등 파이프라인을 개발하고 있다. 먼저, 비마약성의 수술후 통증 치료제 후보물질 ‘GB-6002’는 로피바카인(Ropivacaine) 성분의 약물로 주1회 제형으로 개발 중이다. 기존 심장독성이 있다고 알려진 부피바카인(Bupivacaine) 성분의 약물과 비교해 낮은 독성으로 차별성을 가진다.
이 대표는 “모든 형태의 외과적 수술 이후 나타나는 수술후 통증은 약 2~7일간 치료를 할 필요성이 있다”며 “수술 중에 서방형 비마약성 진통제를 투여함으로써 수술 후 통증관리를 효과적으로 할 수 있을 것”이라고 말했다.
다음으로, 지투지바이오는 서방형 GLP-1 약물인 ‘GB-7001’을 개발 중이다. 현재 제형선정 과정에 있으며, 우선적으로 1개월형을 개발 후 3개월형으로 개량할 계획이다. 마지막으로 반려동물 중성화제를 개발하고 있다. 현재는 수술적 방법으로 중성화를 하고 있는데, 이는 번식이 불가능한 비가역적인 방업으로 윤리적 측면에서 거부감이 있다. 따라서 비수술적이면서 가역적인 의약품이 필요한 언멧니즈(unmet needs)가 있는 분야다.
한편, 지투지바이오는 지난해 114억원 규모의 시리즈B 투자 유치에 성공하며, 시리즈A 포함 누적 214억원의 투자금을 확보했다. 올해 서방형 치매 1상을 완료하고 기술이전 추진 및 시리즈C 투자 유치를 진행할 계획이다.
지투지바이오는 지난 2018년 오송첨단의료산업진흥재단과 서방형 미립구 생산을 위한 GMP 설비를 구축했다. 이 GMP 제조설비는 지투지바이오의 이노램프 기반 미립구 대량생산을 포함해 지투지바이오가 개발하고 있는 치매, 비마약성 수술후 통증치료제 후보물질, 당뇨병 치료제 후보물질 등의 약물들을 생산하는데 최적화된 설비라는 설명이다.

▲지투지바이오 파이프라인(지투지바이오 발표자료 참조)







