기사본문
앱클론, CD19 CAR-T 국내 1/2상 "IND 승인"
입력 2021-12-29 09:28 수정 2021-12-29 09:29
바이오스펙테이터 김성민 기자
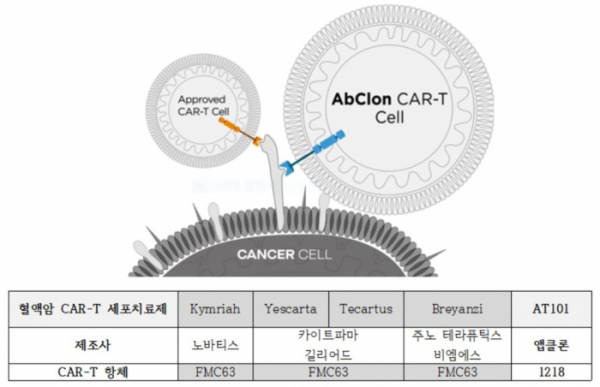
▲AT101 작용 모식도, 출처: 앱클론 제공
앱클론(AbClon)이 식품의약품안전처로부터 CD19 CAR-T ‘AT101’의 혈액암 환자 대상 국내 임상1/2상 임상시험계획서(IND)를 승인받았다고 29일 밝혔다.
앱클론은 서울아산병원과 협력해 내년 상반기에 임상1상의 첫 환자 투여를 시작하겠다는 목표다.
앱클론은 자체 항체발굴 플랫폼 NEST(Novel Epitope Screening Technology)에서 기존 CAR-T에 적용되는 FMC63과 다른 CD19 부위를 타깃하는 새로운 에피토프(epitope)의 ‘1218 항체’를 발굴해 AT101에 적용했다. 현재 시판된 CD19 CAR-T와는 다른 에피토프를 이용하며, 앱클론은 AT101의 전임상시험을 통해 킴리아 불응/재발 모델에서 효능을 확인했다고 설명했다.
이번 승인된 임상은 1상과 2상으로 구성되며, 약 100명의 임상환자를 대상으로 AT101의 안전성, 내약성, 유효성을 평가할 예정이다. 임상1상은 서울아산병원과 협력해 재발성 또는 불응성 B세포 비호지킨림프종(Non-Hodgkin’s Lymphoma, NHL) 환자를 대상으로 안전성, 내약성, 최대내약용량(MTD), 임상2상 권장용량(RP2D)을 결정하게 된다. 임상2상은 전체 반응률(ORR) 등 유효성을 평가하게 된다.
앱클론 관계자는 “이번 임상을 바탕으로 AT101의 효능을 입증하고 관계기관과의 긴밀한 협의를 통해 국내 판매를 위한 조건부 허가를 신청할 계획”이라고 설명했다.
한편 CD19 CAR-T로 킴리아, 예스카타, 테카르투스 등 5개의 치료제가 시판돼 있으며, 국내에서는 킴리아만 허가돼 있다.







