기사본문
RNA치료제 '스핀라자', 척수성근위축증 대상 최초 FDA 승인
입력 2016-12-24 18:13 수정 2016-12-26 09:21
바이오스펙테이터 김성민 기자

안티센스 RNA치료제 개발기업인 아이오니스(IONIS)가 개발한 '스핀라자(SPINRAZA, 제품명)'가 아직 치료제가 없는 희귀병인 척수성 근위축증(SMA, spinal muscular atrophy)에 대한 최초의 치료제로 FDA(미국 식품의약국) 승인을 받았다고 회사측이 23일 밝혔다. 스핀라자는 올해 10월 미국 FDA, 유럽 EMA로부터 희귀의약품으로 지정받아 신속허가절차에 들어갔던 제품이다.
이번 FDA의 승인에 이목이 집중되는 이유는 치료제가 없는 SMA 환자를 대상으로 한 임상3상에서 '매우 우수한 임상결과'를 바탕으로 이룬 성과인데다 아직까지 상업적으로 성공한 RNA 치료제가 없는 상황에서 블록버스터 의약품으로 성장할 가능성이 크기 때문이다.
올해 10월 RNA치료제 선도기업인 얼나일럼 파마슈티컬스(Alnylam Pharmaceuticals)가 레부시란(revusiran)의 임상3상 중단을 발표하면서 하루아침에 주가가 반토막나는 어려움을 겪기도 했다. 해당약물은 RNAi(RNA inteference, RNA 간섭) 방법으로 mRNA가 단백질로 발현되는 것을 막는 원리를 기반으로 한 것으로, 이 후보물질의 임상중단을 계기로 일각에서는 RNA 치료제에 대한 의문이 제기됐다.
이런 상황에 바이오젠-아이오니스가 지난 11월 성공적인 뉴시너센(nusinersen, 스핀라자) 임상3상 결과를 발표하면서 안티센스 RNA 치료제에 대한 관심이 되살아났고, 이번에 FDA의 승인을 획득하면서 많은 기대를 모으고 있다.
스핀라자의 임상3상(CHERISH) 결과를 보면, 운동능력을 평가하는 1차 기준점(endpoint)인 FMSE(Hammersmith Functional Moter Scale Expanded)에서 매우 유의미한 결과(p<0.0001)를 얻었다. 임상3상은 Type 1, 2, 3으로 2-13세 126명 SMA 환자를 대상으로 진행되었으며 15개월 차에 평균 4점에 달하는 향상을 보였고, 치료를 받지 않은 환자들의 경우에는 평균 1.9점 감소했다. 약물투여에 따른 특별한 부작용은 나타나지 않았다.
스핀라자는 시장에 출시될 경우 연간 매출이 10억달러가 넘는 블록버스터 제품이 될 것으로 시장전문가들은 예상하고 있다. 한편, 로슈, 노바티스, Astellas 등 다국적 제약사들이 SMA시장을 겨냥해 임상2상을 진행중이다.
바이오젠은 2012년 아이오니스와 스핀라자에 대한 개발을 진행해왔다. 바이오젠은 스핀라자에 대한 전세계 판권을 확보했으며, 아이오니스는 전세계 승인 후 바이오젠으로부터 1억5000만달러의 마일스톤을 받게 된다.
안티센스 치료제인 '스핀라자'가 겨냥하는 SMA는 매우 심각한 운동신경질환으로 SMN1(survival motor neuron 1) 유전자 상에 결실(deletion) 혹은 결함이 생기거나 SMN 단백질의 발현양이 감소해 나타난다. 이에 스핀라자는 SMN2가 단백질로 발현되기 전 선구물질인 pre-mRNA에 결합해 기능을 할 수 있는 SMN 단백질 발현양을 늘리는 원리다.
SMN은 척수에 있는 신경생존에 핵심적인 요소로 근육신경 발달, 기능에 중요한 역할을 한다. 그렇기에 SMA 증상의 심각한 정도는 SMN 단백질의 발현과 연관되어 있으며, 유아에서 Type 1 SMA는 가장 심각한 생명을 위협하는 정도다. 아동에서 Type 2, 3 SMA는 Type 1에 비해 상대적으로 많은 SMN 단백질을 발현하지만, 일상생활에 어려움을 겪는다.
아이오니스는 이외 바이오젠, 아스트라제네카, 로슈, GSK, Akcea 등과 공동으로 13개 희귀질환, 4개 심장질환, 암, 대사질환을 포함한 29개의 RNA 치료제 파이프라인을 개발중이다. 2013년에 처음으로 심장질환에서 FDA 승인을 받아 제품을 출시한데 이어, 현재 2개 약물을 출시한 상태다. 이외 6개 임상3상, 15개 임상2상 프로그램 등을 진행중이다.
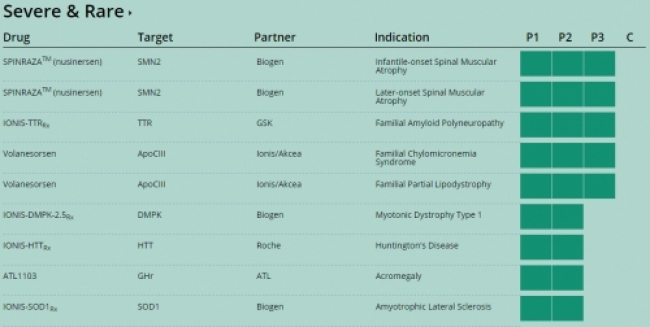
▲임상2, 3상 진행중인 희귀질환 파이프라인출처: 회사 홈페이지
한편, 스핀라자는 국내 바이오회사인 파미셀이 써모피셔에 공급하는 뉴클레오시드를 원료로 사용한다. 파미셀은 이외 아밀로이드 심근증, 아밀로이드성 다발신경병증, 킬로미크론혈증증후군을 포함한 희귀질환 신약후보물질의 뉴클레오시드 원료도 공급한다고 밝혔다.
국내에서는 올리패스가 11월 안티센스 올리고핵산(ASO) 비마약성 진통신약으로 범부처신약개발사업단(KDDF)의 지원과제에 선정된 바 있다. 해당 치료제는 ‘SCN9A’이라는 유전자를 억제해 통증 감각을 매개하는 이온 통로인 Nav1.7을 발현을 저해하는 원리다. 올리패스는 이외 대사질환, 암을 포함한 다양한 파이프라인을 진행중이다.







