기사본문
노바티스 '킴리아' 적응증 추가 FDA 제출 임상 데이터는?
입력 2017-11-02 16:27 수정 2017-11-03 09:38
바이오스펙테이터 김성민 기자
CAR-T 치료제 시장을 두고 노바티스와 길리어드의 물러설 수 없는 한판 승부가 눈앞으로 다가왔다. 노바티스는 지난달 31일 미국식품의약국(FDA)에 세계 최초의 CAR-T 치료제인 '킴리아(Kymriah)'의 미만성거대세포림프종(DLBCL) 적응증 추가를 위한 허가신청서를 제출했다고 밝혔다.노바티스가 FDA에 제출한 임상데이터는 오는 12월에 개최되는 '2017 미국혈액암학회(ASH)'에서 발표할 예정이었다. 향후 DLBCL 적응증에 대한 길리어드와의 경쟁구도가 예상되는 만큼 임상결과는 업계의 궁금증을 자아냈다. 바이오스펙테이터는 지난 1일 노바티스가 2017 ASH에 제출한 초록자료에서 임상데이터를 살펴볼 수 있었다.
킴리아는 최초의 CAR-T 치료제로 재발/불응성(relapsed/refractory) B세포 급성 림프구성백혈병(ALL) 환자를 대상으로 하는 치료제다. 노바티스가 이번에 추가로 신청한 적응증은 지난달 FDA가 승인한 길리어드의 '예스카르타(Yescarta)'와 겹친다는 것이 주목할 점이다. 두 치료제 모두 악성 B세포에 발현하는 CD19을 겨냥한 CAR-T 치료제인 만큼 향후 경쟁구도가 펼쳐질 것으로 예상됐었다. 예스카르타는 B세포 비호지킨림프종(NHL) 환자에서 예후가 안 좋은 DLBCL, 원발성종격동B세포림프종(PMBCL), 변형 여포림프종(TFL) 환자를 대상으로 하는 치료제다. 특히 NHL 적응증에서 DLBCL 환자가 가장 큰 비중을 차지한다.
킴리아와 비교해 예스카르타는 가격면에서 우위에 있다. 단일투여에 따른 비용으로 킴리아는 47만5000달러(5억3500만원)를 책정한 반면 예스카르타는 37만3000달러(4억2200만원)다. 후발주자란 점을 고려한 길리어드의 결정이었다.
그러면 치료효과 및 부작용 면에서는 어떤 차이가 있을까? ASH 초록에 따르면 킴리아(CTL019, tisagenlecleucel)를 주입한 결과, 3개월 후 81명 환자에서 약물투여에 따른 완전관해(CR)가 32%, 종양크기가 30% 이상 감소한 부분 반응률(PR)을 보인 환자는 6%였다.
추적가능한 46명 환자에서 6개월이 된 시점에서 종양이 완전히 없어지는 완전관해는 30%로, 이들 환자군의 95%가 암의 징후가 없는 상태가 유지된 것을 확인했다. 이외 부분관해율은 7%였다. 6개월 무재발생존율(relapse-free survival)은 73.5%에 달했으며, 환자의 말초혈액에서 PCR로 정량한 결과, 최대 367일까지 CTL019가 유지되는 것을 확인했다.
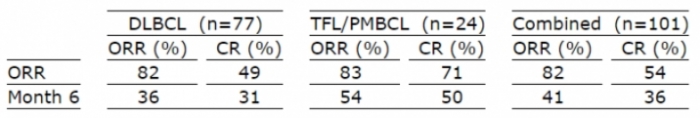
▲예스카르타 임상결과(인수합병 이전 카이트파마가 발표한 임상결과)
예스카르타의 시판허가를 위한 'ZUMA-1' 임상결과에 따르면 6개월 시점에서 31%의 DLBCL 환자에서 CR, 5%의 환자가 PR을 나타냈다. 두 회사의 CD19 CAR-T 치료제를 비교해 보면 DLBCL 환자에서 약물 투여 6개월 후, 효능면에서 큰 차이는 없는 것을 볼 수 있다.
CAR-T 치료제가 상용화되는데 가장 크게 우려가 되는 부분은 부작용이다. 이전 선두주자인 주노에 이어 카이트파마, 셀레틱스의 임상도중 환자가 사망한 예가 있다. 킴리아를 투여한 결과 86%의 환자가 3등급 내지 4등급 부작용을 보였다. 58%의 환자에서 CRS 부작용을 보였으며, 3등급은 15%, 4등급 부작용은 8%다. 15% 환자에 IL-6 항체(tocilizumab) 주입으로 좋은 반응을 보였으며 11%의 환자에 코티코스테로이드가 투여됐다. 이외 신경 관련 부작용(12%), 감염(20%), 열성호중구감소증(13%)이 나타났다. 가장 우려가 되는 CRS, 대뇌부종으로 사망한 환자는 없었다.
예스카르타는 3등급 이상의 부작용(AEs, adverse effects)으로 빈혈(43%), 백혈구감소증(39%), 호중구수감소(32%), 열성호중구감소(31%), 백혈구감소(29%), 혈소판감소(24%), 뇌병증(21%) 그리고 림프구감소(20%) 등이 나타났다. 13% 환자에서 3등급 이상의 사이토카인 신드롬이 나타났으며, 28%의 환자에서 신경성증 부작용이 보였다. 올해 5월 안전성 검증을 위한 추가 코호트 임상에서 한명의 B세포성 비호지킨림프종 환자가 5등급 대뇌부종 부작용으로 사망했다.







