기사본문
식약처, 노바티스 CAR-T ‘킴리아’ "드디어 국내 허가"
입력 2021-03-07 20:54 수정 2021-03-07 20:54
바이오스펙테이터 서윤석 기자
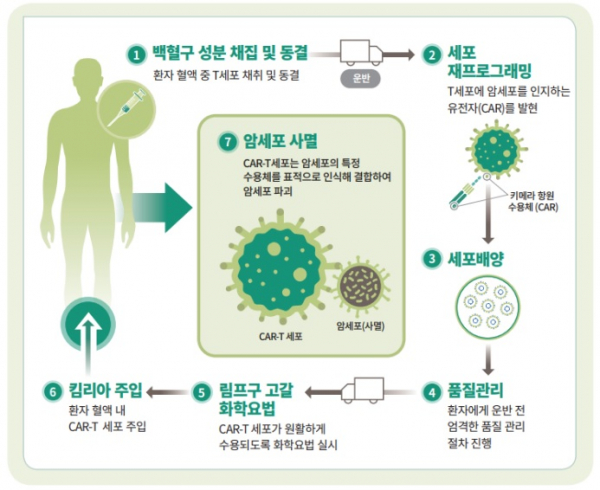
드디어 국내에서 첫 CAR-T 치료제가 승인받았다. 식품의약품안전처는 지난 5일 노바티스의 CAR-T 치료제 ‘킴리아(Kymriah, Tisagenlecleucel)를 첨단재생바이오법에 따른 1호 첨단바이오의약품으로 허가했다고 밝혔다.
이로써 노바티스의 킴리아는 지난 2017년 미국 식품의약국(FDA)에서 승인받은지 4년만에 국내에 들어오게 됐다. 킴리아는 2회이상 치료를 받은 후 재발/불응성을 나타낸 미만성 거대B세포 림프종(BLBCL)과 25세 이하의 B세포 급성림프구성백혈병(ALL) 환자를 대상으로 사용할 수 있다.
CAR-T 치료제는 T세포 수용체와 암세포 표면의 특정항원 인식부위를 융합한 유전자를 환자의 T 세포에 도입한 후 암세포의 표면 항원을 특이적으로 인지하여 공격하도록 하는 기능을 부여한 세포치료제다.
윤성수 서울대병원 혈액종양내과 교수는 “킴리아는 새로운 기전의 혁신적인 1인 맞춤형 치료제이자 1회 치료로 끝나는 원샷 치료제”라며 “이미 2번 이상의 치료와 이식에 실패해 기대 수명이 3~6개월에 불과한 재발성∙불응성 DLBCL 환자들에게 생존율을 높일 수 있다”고 말했다.
식약처는 “이번 품목 허가가 대체의약품이 없거나 표준치료법이 확립되지 않은 재발성·불응성 혈액암 환자에게 새로운 치료 기회를 제공할 수 있을 것이라 기대한다”고 말했다.







