기사본문
3세대 EPO 가능할까? 항체 플랫폼 'HyFc'에 대한 기대
입력 2016-08-09 14:00 수정 2016-08-09 14:00
J. Ryang 객원기자
제넥신은 시판된 제품없이 진행중인 신약 파이프라인의 가치만으로도 매우 높은 평가를 받고 있다. 그 중심에는 HyFc(Hybrid Fc)라는 지속형 항체 플랫폼기술이 자리한다. GX-E2는 제넥신이 개발중인 3세대 EPO(Erythropoietin)제제다. GX-E2는 HyFc의 시장가치를 꽃 피우기에 가장 좋은 파이프라인인 동시에 HyFc를 설명하기에 가장 좋은 예시가 될 수 있다. 이번에는 3세대 빈혈치료제인 GX-E2를 중심으로 제넥신과 HyFc에 대해 설명하고자 한다.
일전에 ‘빈혈과 EPO, 그리고 바이오시밀러–팬젠’(http://biospectator.com/view/news_view.php?varAtcId=1043)을 통해 이미 개발된 그리고 개발중인 EPO 빈혈치료제들에 대해 언급한 바가 있다. 이전 글에서 EPO 약물로 이미 시장에 진출해 있는 약물들은, 1세대 Epogen, 2세대 Aranesp가 있다고 했다. 그 다음단계 후보의 하나로 제넥신의 GX-E2을 들 수 있다.
EPO와 빈혈, EPO시장, 그리고 제넥신의 GX-E2
EPO(Erythropoietin)은 신장유래 물질로 골수에서 조혈모세포에 작용하여 적혈구 원시세포의 분열과 분화를 자극한다. 이 물질의 생체공급이 결핍되면 빈혈이 생긴다. EPO 부족의 원인으로 가장 큰 것은 신장의 손상인데, 신장은 당뇨병을 비롯한 여러 가지 만성질환으로 인해 망가지기 쉽고, 만성질환에 대한 약물복용과도 큰 상관관계가 있다. 고령화는 만성질환 유병률과, 만성질환은 신장 손상과 상관관계가 높다. 결론적으로 고령화가 진행됨에 따라 EPO제제의 수요는 늘어날 것으로 보인다.
EPO제제의 글로벌 시장규모는 10조원이 조금 안 되는 수준이고, 그 중 1세대 EPO제제가 과반을 살짝 넘는 점유를 보이고 있다. 나머지 시장에 대해서는 2세대 EPO제제들이 차지하고 있다. 1세대보다 우월한 2세대 약물의 등장이 기존의 EPO시장을 모조리 가져가지는 못했다. 하지만 2세대 약물 Aranesp은 첫 등장인 2004년부터 지금까지 3조원에 가까운 매출을 내며 엄청난 파괴력을 보여줬다.
제넥신의 GX-E2는 3세대 EPO제제다. 이 약물은 2006년부터 녹십자와 공동개발 중이다. GX-E2가 시장에 풀리게 되면 단연 Best in Class가 된다. 1세대 약물이 그냥 EPO라고 한다면, 2세대 약물은 이 약물이 몸 속에서 오래 작용하도록 만든 것이다.
3세대에 해당하는 GX-E2는 기존 2세대 약물보다 같거나 높은 지속력을 갖고 환자의 몸에서 작용한다. 2세대 약물과의 차별성은 훨씬 더 높은 안전성과 높은 공정수율로 생기는 원가절감 효과에 있다. 제넥신의 GX-E2에 대해서 아직까지 밝혀진 부작용이 없다는 것은 GX-E2의 3세대 약물로서의 입지를 더욱 공고히 한다.
Hybrid Fc에 대하여
GX-E2가 뛰어난 안전성과, 높은 생체 지속력을 증명할 수 있는지에 대해서는 GX-E2에 적용한 제넥신의 Hybrid Fc 플랫폼 기술에 대해 살펴봐야 한다.
제약업계 ‘생체지속성 약물 플랫폼’ 양대산맥의 하나는 한미약품의 랩스커버리(LAPSCOVERY – Long Acting Protein / Peptide Discovery Platform Technology)이고, 다른 하나는 제넥신의 HyFc(Hybrid Fc)일 것이다. 약물지속성을 내기 위하여 기존의 약물들은 폴리에틸렌글리콜(PEG)이라는 생체고분자를 붙이는 PEGylation기술을 사용하거나, 생체유래 면역글로불린인 IgG1을 사용하는 등의 방법을 사용하였다. 아래의 그림을 보면 약물지속성을 늘리기 위한 다양한 기반기술들에 대해 알 수 있다.
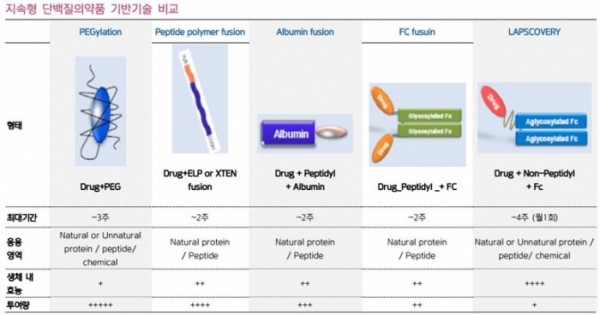
(지속형 단백질 기반기술 비교(출처 한미약품))
한미약품의 랩스커버리는 이러한 기존 기술들의 장점들을 뽑아 만든 기술이다. 랩스커버리가 다른 기존의 기술들보다 몸에서 지속되는 지속 최대시간이 1~2주 이상 오래 가는 것, 응용영역이 가장 넓은 것, 생체 내 효능이 가장 높고 많은 투여량이 필요 없다는 것 등을 알 수 있다.
한미약품의 랩스커버리가 기존의 기술들(PEG + IgG1)을 잘 배합하여 만든 기술이라고 한다면, 제넥신의 HyFc는 기존에 쓰이지 않았던 생체유래물질 IgG4와 IgD의 장점을 융합하여 만들어진 신개념 기술이다. Ig는 Immunoglobulin의 약자이고 다른 말로 항체라고 생각하면 된다. 항체의 많은 종류 중 항체G4와 항체D가 갖는 장점이 있는데, 이들의 생물학적 장점을 융합하여 하나의 새로운 항체를 창조해낸 것이다. 이들은 기존 생체분자의 절편들이 조화롭게 융합되었기에 생체에서 면역원으로 인식하지 않는다.

(IgD와 IgG4의 장점(출처 제넥신))
IgG4와 IgD는 기존에 사용되었던 IgG1에 비해 장점이 될만한 여러 요소를 갖고 있다. IgD의 Hinge flexibility는 단백질끼리의 상호간섭을 최소화하여 약물의 효과를 높이는 장점을 지니고 있다. 이는 기존 IgG1 Fc기술이 적용된 약물보다 250% 높은 약물활성을 띄도록 하는 역할을 한다. 또한 IgD의 ‘항체의존적 세포독성 – ADCC’와 ‘보체 의존적 세포독성 – CDC’를 일으키는 반응매개체들과의 결합을 차단하는 특성을 가져와 세포독성에 대한 문제가 없다. IgG4가 융합에 사용됨으로써 생기는 장점은 FcRn과의 결합이 유도되어 약물이 자연스럽게 생체 내에서 재활용 될 수 있다는 점과 높은 반감기에 따른 지속력이 있겠다. HyFc는 IgD와 IgG4의 융합단백질로, 이들의 모든 장점을 다 갖고 있다.
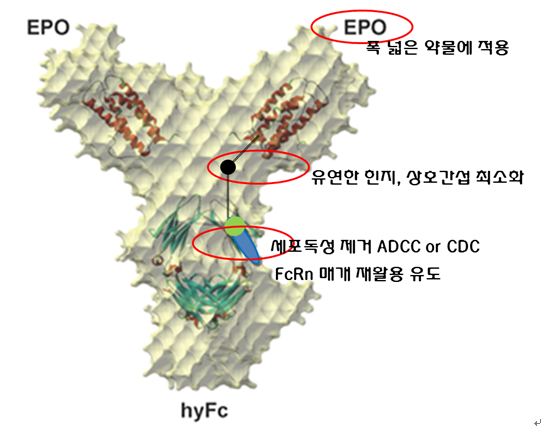
(HyFc의 모습(출처 GX-E2논문))
또 하나 HyFc는 아찔하게 신장이 투과시킬 수 있는 분자량 50kD을 넘는 60kD이기 때문에 신장으로의 물리적인 배설이 적다는 특징도 갖고 있다. 분자량이 너무 커지면 투여시 이물감 또는 통증이 유발된다는 문제가 있고, 분자량이 50kD이하여서 신장으로 배설된다면, 체내에 머무르는 시간이 적어져 지속형 약물로써 적용될 수 없다.
‘한미약품 – 랩스커버리’와 ‘제넥신 – HyFc’의 상대적인 장점에 대하여 한가지씩만 언급하자면, HyFc가 다국적제약사에 대규모 기술수출이 된 사례가 없다는 것에 대해 랩스커버리는 이미 대규모 기술이전을 이뤄낸 바 있는 시장성이 검증된 기술이라는 점과 HyFc는 랩스커버리 플랫폼에 비해 공정이 간단하여 원가절감율이 높다는 점을 들 수 있다.
GX-E2는 기존의 1세대 및 2세대 EPO제제들이 갖고 있지 못한 모든 장점을 갖고 있다. 신장세포를 완벽하게 복원시켜 우리 몸에서 자연히 EPO가 생성되도록 만드는 약이 개발되지 않는 한 GX-E2는 압도적으로 훌륭한 EPO약물이 될 가능성이 높은데, '이 가능성이 언제쯤 현실로 다가올 수 있을까' 그 시점이 기다려진다.







