기사본문
[BioS 레터]큐리언트 ‘텔라세벡’ 개발과정과 시사점
입력 2023-02-06 08:56 수정 2023-02-07 18:44
남기연 큐리언트 대표

▲남기연 큐리언트 대표
호흡기를 통해 공기 중으로 전염되는 결핵(Tuberculosis)은 전 세계적으로 약 20억명이 감염되어 있는 세균성 질환이며, 매해 약 140만명을 사망으로 이르게 하는 무서운 질병이다. 결핵은 지난 2000년 이상 인류의 역사와 같이해왔다고 할 만큼 오랫동안 지속적으로 발병해왔으며 우리 주변에서도 심심치 않게 환자가 생겼다는 소식을 듣기도 하지만, 사람들은 크게 개의치않는 것 또한 사실이다. 비슷하게 공기 중으로 전염되는 COVID-19 pandemic으로 인해 전세계 사회/경제가 마비되는 것을 볼 때, 우리가 결핵을 대하는 자세는 사뭇 놀랍기도 하다. 결핵에 대한 이런 ‘의연함’은 어디에서 나오는 것일까? 많은 사람들은 결핵은 감염이 돼도 치료가 되는 질병으로 알고있는 것이 의연함의 원인일 것이라 생각된다. 현실적으로 생각해봤을 때 50% 맞는 생각이다.
일반적으로 결핵에 걸리면 아이소니아지드(isoniazid)와 리팜피신(rifampicin)이 포함된 3~4종의 항생제를 병용 투여받게 되고 6~9개월간 꾸준히 복용하면 완치된다. 그러나 운없게 이미 표준치료법에 내성이 생긴 다제내성결핵(multi-drug resistant tuberculosis)에 걸리게 되면 표준 치료법은 무용지물이 된다. 전세계 결핵 환자의 약 4% 정도가 다제내성결핵에 감염되는 것으로 알려져 있으니 그 비율이 낮지는 않다.
다제내성결핵의 경우 5~6가지 이상의 주사제를 포함한 항생제를 18~24개월간 투여받아야 하고 완치율도 일반 결핵에 비해 훨씬 낮은 것도 문제지만, 결핵진단 후 감염된 균이 일반결핵인지 다제내성결핵인지 확진하는 약제 감수성 검사기간이 2~3달이 족히 걸린다는 것이다. 즉 2~3달동안 일반 결핵 표준치료법을 받고있다가 다제내성결핵 감염으로 판명될 경우 조기 치료시기를 놓쳐 이미 병세가 악화될 수도 있다. 현재는 리팜피신에 대한 내성여부만을 분리된 결핵균의 유전자 검사를 통해 알아보는 것이 최선의 선택이다.
대한민국과 같이 의료 시스템이 잘 갖춰져 있는 나라에서는 국가관리 질병인 결핵감염 시 적절한 치료가 될 수 있도록 추적관리 시스템을 통해 환자의 복약지도를 하고 있어 항생제 내성의 발생 빈도가 낮은 편이나, 결핵이 만연해 있는 저개발 국가들에서는 일반 결핵에 감염되었더라도 항생제를 6~9개월간 꾸준히 복용하는 것이 쉬운 일이 아니다. 일반 결핵 감염 후 낮은 항생제 복약 순응도로 인해 내성 결핵으로 악화될 가능성이 높아지는 것이다.
그래서 결핵이 치료가 되는 감염병이라는 인식은 50%만 맞는 얘기인 것이다. 결핵을 전세계에서 실질적으로 치료 및 관리 가능한 질병으로 만들기 위해서는 결핵 치료제 개발사는 2가지 조건을 충족시켜야 한다. ▲결핵 확진 시, 감염된 결핵균의 약제 내성 여부와 관계 없이, 즉 약제 감수성검사 없이 투약해도 어떤 결핵에서도 효과가 있는 약 ▲치료기간을 최대한 단축하여 저개발 국가에서의 복약 순응도를 높힐 수 있는 약이 그것이다. 전세계 결핵 치료제 개발 기관들은 이러한 조건을 충족시킬 수 있는 꿈의 병용처방법, 즉 ‘Universal Regimen’을 구성하기 위해 노력해왔다.
텔라세벡(Telacebec)은 이 2가지 조건을 모두 충족시킬 수 있는 약으로 개발되었다. 텔라세벡은 결핵균의 에너지 대사과정 중 전자전달계 내 싸이토크롬 bc1 복합체(cytochrome bc1 complex)를 저해하는 항생제로 최초 시도되는 작용기전을 가져 기존의 어떤 항생제 내성과도 관계없이 효과적으로 결핵균을 사멸시킬 수 있다. 또한 결핵균의 에너지 생성을 저해함으로써 분열하지 않는 결핵균도 사멸시켜 전체 치료기간을 단축시킬 수 있다. 또한 복약 순응도를 높힐 수 있도록 하루 한번 복용하는 약동력학적 특징을 가지고 있으며, 다른 항생제들과 병용처방되는 만큼, 약물 상호작용을 최소화하였다. 대부분의 약물이 parent form으로 배설될 만큼 대사율이 낮은 것도 다른 약의 영향을 받지않는 원인이기도 하다. 또한 저개발 국가에도 판매되기 위해 낮은 제조원가를 확보한 것도 강점 중 하나이다. 이와 같이 텔라세벡 개발과정 중에서 계획했던 것들을 하나씩 달성해가고 있다.
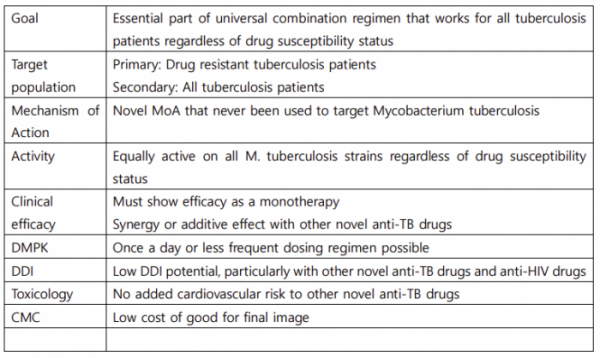
▲Target Product Profile
텔라세벡을 개발하는 과정에는 여러가지 어려움이 있었다. 텔라세벡의 선도물질은 한국파스퇴르연구소에서 Phenomic Screen™이라고 하는 high content screening(HCS) 기술을 통해 약 20만개 화합물을 스크리닝한 결과를 통해 발견되었다. HCS의 장점은 생리적 현상과 가장 가까운 평가지표(end point), 즉 대식세포 내외에서의 결핵균의 사멸을 직접 관찰하여 화합물을 선별한 만큼, 실질적 효능이 있는 선도물질이 나올 가능성이 높지만, 물질의 작용기전을 모르는 것이 가장 큰 난관이었다. 결국 선도물질에서 텔라세벡이 나오기까지의 최적화 과정은 정확한 타깃을 모른 상태에서 진행되었다.
신약으로서는 큰 리스크를 가지고 프로그램이 진행된 것이다. 텔라세벡을 후보물질로 선정할 즈음, 글로벌 제약사인 노바티스사의 열대병연구소에서 텔라세벡과 유사한 시리즈의 화합물을 개발하고 있다는 소식을 접하였고, 다행히 우리의 연구 진도와 특허 출원이 빨라 노바티스는 자체 프로그램을 중단하고 큐리언트와 협력하기로 하였다. 당시 노바티스 열대병연구소가 앞서 있었던 부분은 자체 개발한 화합물에 대한 내성 균주를 유도해 가지고 있었다는 것이다. 노바티스와의 협력을 통해 텔라세벡을 노바티스의 내성 균주에 테스트할 수 있었고, 동일 타깃임을 확인할 수 있었다. 즉, 텔라세벡의 타깃이 싸이토크롬 bc1 복합체 중 b 단위체인 QcrB라는 것을 밝혀낸 것이다. 큐리언트, 한국파스퇴르연구소, 노바티스 3개 기관의 공동연구를 통해 텔라세벡의 개발과 작용기전을 밝혀낸 논문을 네이처 메디슨(Nature Medicine)에 발표하게 되었다. 같은 계열의 화합물을 개발하는 경쟁관계에서 공동 논문을 발표하는 협력관계로 돌아서는 좋을 사례를 만들었다고 평가할 수 있다.
텔라세벡의 임상1상 개발이 미국에서 진행되고 있을 즈음, 임상2상을 어디에서 진행해야 할지가 가장 큰 숙제였다. 미국 내에서는 확보할 수 있는 결핵 환자가 매우 한정적이라(따라서 희귀 의약품 및 Priority Review Voucher에 해당되기도 하지만) 미국 외의 지역에서 임상2상을 진행해야 하는 상황이었다. 즉, 마땅히 환자를 확보해 임상2상을 진행할 수 있는 루트를 찾는 것이 쉽지 않았다. 결핵도 많이 발생하지만 첫 효능 평가인 만큼, 의료기반 시설이 잘 갖추어진 환경이 필요했던 것이다. 한국의 결핵 발병률이 OECD 국가 중 가장 높은 만큼, 의료환경이 좋은 한국내 임상2상을 고려해보기도 하였으나, 국내에서는 좋은 결핵 관리시스템으로 인해 오히려 신약 임상에 참여하고자 하는 환자를 찾기가 더 힘들다는 전문의들의 의견을 들을 수 있었다. 국제 결핵 치료제 및 백신개발 연구자 사회에 나선지 얼마되지 않는 큐리언트로서는 결핵 임상의 실질적 수행에 필요한 정보들이 매우 부족한 상황이었다.
뒤돌아봤을 때, 당시 가장 잘한 일은 국제 결핵사회에 첫 선을 보인 큐리언트이지만 우리의 소통방법은 직설적이고, 우리의 당시 개발전략 및 목표를 숨기려하지 않았다는 것이다. 이러한 직설적인 소통을 통해 유럽 및 미국 결핵 치료제 임상연구자들과의 신뢰를 쌓을 수 있었고, 임상1상 진행 중, 남아프리카공화국에서 진행된 결핵 치료제 개발회의에 초청받아 현지 오피니언리더(opinion leader)들과 교류하며, 남아공에서의 임상2상 진행 가능성을 보게 되었다. First-in-class 결핵 치료제 임상2상의 대가인 안드레아스 디아콘 박사와 로드니 도슨 박사도 만나 남아프리카공화국의 결핵 임상시험 기반시설 및 경험에 대한 설명을 듣고 임상2상 계획을 할 수 있었다. 막상 임상2상 오퍼레이션에 진입하면서는 임상사이트 임상책임자(principle investigator)나 CRO 이외에도 현지에서 회사를 대변하고 임상기관들과 직접 협력할 수 있는 직원이 필요하다. 남아프리카공화국까지 가는데 비행시간만 20시간 이상 걸리는 것을 감안할 때, 쉽지않은 일이었다. 큐리언트가 국제사회에서 쌓은 신뢰관계를 통해 현지에서 결핵 임상을 다수 참여한 메디컬 모니터(medical monitor)와 프로젝트 매니저(project manager)를 채용할 수 있었고, 이분들이 현지 오퍼레이션을 전담하여 성공적인 임상 수행에 큰 힘이 되었다.
많은 비즈니스가 그렇듯, 신약개발 사업에서도 가장 중요한 것은 motivation, 즉 동기부여라고 생각된다. 우리가 같이 일하는 파트너들에게 우리의 비전을 정확하게 전달하려 노력하고, 성공 가능성이 높고 사회기여도가 높은 신약개발에 같이하자는 설득이 가장 큰 동기부여가 되고, 직원들에게도 국내에서 흔치 않은 first-in-class 신약개발을 주도한다는 자부심과 결핵이라는 난치병에 대한 치료제를 개발한다는 자긍심이 가장 큰 동기부여가 된다고 생각된다. 결핵치료제인 텔라세벡을 선도물질 발굴부터 임상2상까지 진행해 오면서, 이러한 동기부여의 중요성을 새삼 느끼게 된다. 내가 느끼는 만큼 다른 사람도 느낄 수 있도록 직설적인 소통은 동기부여에 좋은 방법이라 생각된다. 신약개발은 환자를 위한 일이라는 것에 동기부여가 되는 사람들이 아직도 많이 있다는 것에 위안을 받는다. 신약개발에 종사하면서, 이 분야가 과하게 상업화되는 과정을 지켜보면서, 현대 신약개발이 처음 시작될 때 즈음 조지 머크(George W. Merck)가 1950년 연설한 내용이 상기 된다.
“We try to remember that medicine is for the patient. We try never to forget that medicine is for the people. It is not for the profits. The profits follow, and if we have remembered that, they have never failed to appear. The better we have remembered it, the larger they have been.”
“우리는 신약이 환자를 위한 것이라는 것을 기억하려 해야합니다. 신약이 사람을 위한 것이라는 것을 잊으면 안됩니다. 신약은 이윤을 목적으로 하는 것이 아닙니다. 이윤은 따라오는 것입니다. 우리가 이 점을 잊지 않는다면 신약은 계속 나올 것이고, 그에 따른 이윤도 극대화될 것입니다.”







