기사본문
KDDF 공개할 신약물질 30선 중 4개 미리 살펴보니
입력 2019-02-12 08:46 수정 2019-02-20 15:21
바이오스펙테이터 조정민 기자
범부처신약개발사업단(KDDF)이 미국, 영국, 독일, 호주 등 전세계 연구기관에서 발굴한 혁신신약 후보물질을 국내에 소개한다. 국내 제약사 및 바이오텍의 신약 파이프라인 강화를 위해 해외 연구기관과 손잡고 진행하는 프로젝트다.
오는 20일 서울 중구 포스트타워(10층)에서 열리는 ‘글로벌 C&D TECH FAIR’에서는 기초 의생명과학 연구역량이 탁월한 해외 대학과 연구소에서 발굴한 신약 후보물질 30종이 포스터 및 프리젠테이션을 통해 소개될 예정이다. 항종양분야와 중추신경계질환 뿐만 아니라 호흡기계, 심혈관계, 위장관계 등 다양한 치료 분야를 아우르는 다양한 신약후보물질이 준비돼 있다. 바이오스펙테이터는 그 중에서 눈여겨 볼 만한 4개의 파이프라인(anti-TACE 항체 치료제, GalR2 작용 기전 통증 치료제, MOZ 억제 기전 항암제, Midkine 항체 항암제)를 미리 소개한다.

◇ Cancer Research UK의 anti-TACE 항체 치료제
영국 'Cancer Research UK'는 TACE(종양괴사인자-α 전환효소, TNF-α converting enzyme)를 타깃으로 하는 항체 후보물질을 항암치료제로 발굴했다. TACE는 세포막에 부착돼 있는 TNF-α, EGF(epidermal growth factor) 등의 기질단백질을 떼어내는 금속단백질분해효소(metalloprotease)로 체액 내 기질단백질의 양을 조절하는 것으로 알려졌다. TACE는 종양의 발생과 성장, 전이과정의 세포-세포 또는 세포-세포외기질 사이의 상호작용에서 중요한 역할을 수행하며 뇌종양, 유방암, 대장암, 위암, 간암, 폐암 등 다양한 암 종에서 과발현하는 것이 관찰됐다.
TACE의 활성은 화학적 항암치료에 대한 종양세포의 치료반응에도 중요한 요소다. 실제 대장암 세포주를 이용한 실험에서 화학적 항암제와 TACE 억제제를 함께 적용했을 때, 암세포의 세포사멸이 더 증가했다. 화학적 항암제와의 병용을 통한 치료 효과 증진을 기대할 수 있는 것이다.
뿐만 아니라 최근 연구 결과들을 살펴보면, 상피성장인자(EGF) 조절에 관여하는 TACE의 억제제를상피성장인자수용체(EGFR)를 타깃하는 표적항암제와 병용했을 때 추가적인 치료 효과 또한 기대할 만 하다.
이전에도 TACE를 억제하기 위한 저분자화합물에 대한 개발을 지속적으로 이뤄져왔다. 하지만 금속단백질분해효소 패밀리의 상동성이 높은 것이 걸림돌로 작용했다. 타깃인 TACE에 대한 결합 특이성이 낮은 것이 문제가 된 것이다.
Cancer Research UK 연구진은 높은 결합 특이성을 가진 단일클론항체에 긴 반감기를 가진 면역글로불린을 결합하는 방법을 통해 효과적으로 TACE를 억제하는 후보물질을 발굴했다. 이들은 TACE의 촉매 도메인(Catalytic domain) 뿐만 아니라 이웃한 시스테인 도메인(Cysteine domain)에도 결합이 가능해 결합력을 높인 항체를 발굴했다. 발굴한 항체 후보물질을 전체 인간 IgG1 형태로 재형성함으로써 체내 순환과정에서의 반감기도 늘릴 수 있었다.
이들은 자연적으로 TACE를 억제하는 단백질 N-TIMP3와 해당 후보물질의 TACE 억제 기능을 비교하는 세포 실험을 통해 후보물질이 N-TIMP3보다 5배 이상 뛰어난 TACE 억제효과를 가졌으며 TNF-α, TGF-α, EGF 등의 기질단백질 분비를 효과적으로 억제하는 것을 관찰했다.
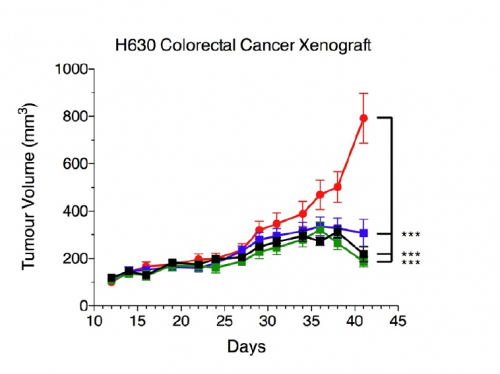
▲Red: 대조군, Blue: 7.5mg/kg, Green: 10mg/kg, Black: 15mg/kg
대장암 세포주를 이식한 동물모델을 이용한 실험도 진행했다. 총 32마리의 동물에게 종양세포를 이식하고 14일 뒤, 4개의 군으로 나눠 주 1회 PBS(대조군), 후보물질 각각 7.5mg/kg, 10mg/kg, 15mg/kg 을 각각 적용한 결과에서 3개의 후보물질 적용군 모두 대조군 대비 종양의 크기가 유의미하게 작은 것을 확인했다. 10mg/kg 적용군의 경우 대조군과 비교해 4배 가량의 종양 억제 효과가 관찰됐다(평균 종양크기 대조군 800mm3, 10mg/kg군 200mm3).
Cancer Research UK 연구진은 해당 후보물질은 처음 소개되는 anti-TACE 항체로 다양한 암 종과 염증성 질환에 폭넓은 적용이 가능해 높은 시장성을 기대한다고 설명했다.
◇ LifeArc의 GalR2 작용 기전 통증 치료제
영국의 LifeArc 연구소는 신경병증성 및 염증성 통증 치료 후보물질을 소개한다. 이들은 통각에 중요한 역할을 하는 갈라닌 수용체 2형(GalR2)을 타깃하는 펩타이드 물질을 개발했다.
갈라닌(Galanin)은 30개의 아미노산으로 이뤄진 신경전달물질로 뇌와 척수, 위장관계 등에서 발현한다. 갈라닌은 수면 및 기분 조절, 인지기능에 관여하며 통각의 조절에 중요한 역할을 하는 것으로 알려졌다. 좌골신경계 손상모델 등에서 후근신경절 세포(DRG neuron)에서 눈에 띠게 증가하는 것이 관찰되면서 상해 반응 신경물질로 추측되고 있으며 다양한 기능적 연구를 통해 갈라닌이 척수 통각 반사를 조절할 수 있음이 밝혀졌다. 또한 갈라닌은 신경조직 외에 각질세포, 땀샘, 대식세포, 혈관과 같은 말초조직에서도 발현하는데 이를 통해 말초 통각 기능을 조절하게 된다.
G단백질 결합 수용체(G-protein coupled receptor; GPCR)인 갈라닌 수용체는 1형, 2형, 3형 총 3가지 형태가 존재하는데 그 중에서도 2형 수용체(GalR2)가 중추신경계 등에서 신경병증성 통증 조절에 관여한다는 연구 결과들이 발표된 바 있다. GalR2가 활성화되면서 신경세포의 칼슘 채널 활성이 억제되고고 통증에 결정적인 역할을 수행하는 바닐로이드 수용체(TRPV1) 발현을 조절함으로써 통증을 조절할 수 있다는 것이다.
이러한 연구결과들을 토대로 LifeArc 연구진은 GalR2를 타깃으로 하는 통증 치료제를 개발, 갈라닌-Fc 융합 단백질을 재조합한 후보물질을 발굴했다.
세포실험에서 후보물질은 3가지 형태의 갈라닌 수용체 가운데 2형 수용체에 선택적으로 작용해 높은 활성화 상태를 유지했다. 또한 말초 내에서 제한적으로 작용해 중추신경계 독성에 대한 위험이 낮았다.
기존 신경병증성 통증의 표준 치료제와의 비교를 위해 진행한 만성 수축성 손상(chronic constriction injury; CCI) 동물실험에서도 농도 의존적인 효과를 확인할 수 있었으며 1회 투약 이후 96시간 동안 통증이 없는 무통증(analgesia) 상태가 유지되는 것을 관찰했다. 연구진은 어떤 용량에서도 동물의 진정(sedation) 징후가 보이지 않았으며 장 운동 역시 문제 없었다고 설명했다. 이는 통증을 조절하는 것 이외에 다른 부작용에 대한 우려가 낮다는 것을 의미한다.
LifeArc 연구진은 통증을 효과적으로 조절하고 기존 치료제 부작용을 해결함으로써 미충족 수요를 해결할 수 있을 것으로 기대하고 있다. 현재 물질 최적화를 진행하고 있으며 전임상을 준비 중이다.
◇ Monash university의 MOZ 억제 기전 항암제
호주의 Monash 대학교 연구진은 B세포의 증식과 발달에 영향을 미치는 히스톤아세틸전달효소 MOZ를 억제해 림프종을 치료할 수 있는 저분자화합물의 개발 파트너를 찾기 위해 나선다.
줄기세포 또는 전구세포를 성숙한 혈액세포로 만드는 조혈과정에는 염색질 변화와 핵 효소 등이 작용해 조절이 이뤄진다. MOZ는 아세틸화된 히스톤으로 인한 염색질 입체구조를 조절하는 역할을 하는 단백질로 급성 골수성 백혈병에서 MOZ와 CBP(cAMP-responsive element binding protein) 간의 융합이 야기한 염색질 입체구조를 발견한 연구 결과가 발표된 바 있다. CBP 외에도 P300, TIF2 등이 MOZ의 전좌에 관여하는 것으로 알려졌는데 이러한 MOZ의 염색질 전좌는 조혈모세포의 악성 변화를 야기하며 병의 진행을 촉진하는 것으로 보고됐다.
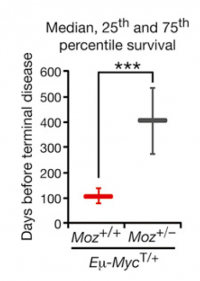
실제로 MOZ의 전좌로 유발된 백혈병 환자의 중간 생존값은 진단 후 2~10개월에 불과하다. 연구진은 MOZ가 가지는 치료 타깃으로써의 가능성을 확인하기 위해 진행한 형질전환 B세포 림프종 동물모델 실험에서 MOZ 유전자 한 쌍 중 한 개가 발현되지 않은 동물(MOZ+/-)이 모두 발현한 동물(MOZ+/+)보다 4배 이상의 기간동안 생존한 것을 확인했다. 이러한 결과는 MOZ를 억제하는 것이 림프종 등의 혈액암 진행을 억제하고 치료 예후를 개선할 수 있는 가능성을 설명해준다.
Jonathan Baell 교수를 비롯한 Monash 대학교 연구진은 24만3000개의 저분자 물질을 스크리닝함으로써 MYST family 억제가 가능한 물질을 선별했다. 이 중에서 MOZ와 MYST4에 선택적 결합력이 높은 후보물질을 선정했다.
해당 물질들은 세포실험에서 B세포림프종 세포의 성장을 효과적으로 억제했다. 또한 마우스 동물에 적용했을 때에도 전체 골수 세포질에 영향을 주지 않고 B세포 전구세포의 수를 감소시키는 것을 확인했다.
연구진은 MOZ가 B세포 전구세포의 분화 능력을 유지하기 위해 필요한 유전자 네트워크에서 중요한 조절자로 작용하고 있으며 이를 부분적으로 억제하는 것으로 조혈모세포의 악성화 진행을 막을 수 있을 것이라고 예측하고 있다. 이들은 이번 행사를 통해 MOZ 억제제를 효과적으로 개발하는데 함께 할 파트너를 찾을 예정이다.
◇ CELLMID의 Midkine 항체 항암제
Midkine은 헤파린 결합 사이토카인 중 하나로 세포의 증식 및 이동, 혈관형성, 섬유소 분해 등에 중요한 역할을 한다.
배아형성기에는 발현이 관찰되지만 건강한 성인에게서는 거의 발현하지 않는 Midkine은 뇌종양, 대장암, 간암 등을 포함하는 대부분의 암에서 증가하며, 발현량이 높은 암환자일수록 예후가 나쁜 것으로 알려졌다. Midkine은 암세포의 증식 활동과 종양미세환경의 혈관 형성을 강화한다. 또한 Caspase-3와 같은 세포사멸 신호전달체계를 억제하고 반대로 mTOR, PKB 등의 생존 신호체계를 자극함으로써 암세포의 생존을 늘리기도 한다. 이 밖에도 다양한 경로를 통해 화학적 항암제 내성 등에 관여함으로써 치료 예후를 악화시키는 것으로 알려졌다.
2017년 국제학술지 ‘Nature’에 발표된 논문에 따르면 종양에서 발현된 Midkine은 림프관을 새로 형성해 전이를 수월하게 하는 동시에 원거리 전이를 촉진한다. 또한 Midkine 발현이 낮은 환자보다 높은 환자의 무진행 생존기간이 훨씬 짧은 것으로 관찰됐다.
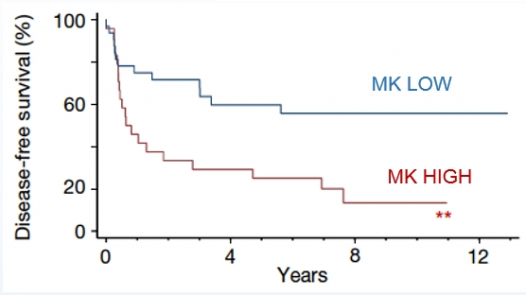
흑색종 동물모델을 이용한 실험에서는 유전자 벡터를 이용해 Midkine 발현을 감소시키자 전이가 유의미하게 억제됐다. 이는 Midkine이 항암 치료의 타깃으로써 가능성이 높다는 것을 의미한다.
호주의 CELLMID는 이러한 Midkine의 특성을 바탕으로 암의 예후를 예측하는 바이오마커로 활용하는 동시에 항암 치료를 위한 항체 치료제 발굴을 진행했다. Midkine을 타깃하는 4개의 항체 후보물질 가운데 3개 항체의 인간화를 진행했으며 선도 물질 CAB102는 단일 용량 독성과 약동학을 파악하기 위한 GLP실험을 수행하고 있다.
해당 연구진은 143B 골육종(osteosarcoma) 세포를 이식한 이종이식동물모델에게 Midkine 항체를 적용하자 폐 전이 비율이 4배 이상 감소했다고 밝혔다. 4T1 유방암세포 이종이식모델에서도 비슷한 폐 전이 억제 효과를 확인했다.
이들은 “25종이 넘는 다양한 암에서 Midkine이 발현하는 것을 확인했다”며 범용적인 항암제로서의 가능성을 시사했다. 또한 Midkine이 면역체계와도 밀접한 관련이 있기 때문에 각광받는 면역관문억제제와 병용했을 때의 시너지 효과도 기대할 수 있다.
CELLMID는 Midkine 항체에 대해 탄탄한 특허 보호망을 구축했으며 미국 FDA와 임상 진행을 위한 사전 미팅(pre-IND)을 진행하고 있다. 이들은 암 환자를 대상으로 Midkine 항체 후보물질의 안전성과 내약성을 평가하기 위한 임상1b상을 계획하고 있다.







