기사본문
인투셀, 新링커 적용 'B7-H3 ADC' "KDDF 과제선정"
입력 2019-03-08 15:24 수정 2019-03-08 15:40
바이오스펙테이터 김성민 기자

▲박태교 인투셀 대표(왼쪽), 묵현상 KDDF 단장(오른쪽).
인투셀이 자체 개발한 링커 플랫폼인 OHPAS(Ortho-Hydroxy Protected Aryl Sulfate)를 적용한 비소세포폐암 항암제 개발을 본격화한다. OHPAS 링커는 혈중에서 높은 안정성을 유지하며, 기존에 어려웠던 독성 항암제까지 결합할 수 있는 차별성을 가진다.
인투셀은 면역관문 분자인 'B7-H3'를 타깃하는 항체-약물 복합체(Antibody-drug conjugate, ADC)로 비소세포폐암 치료제를 개발하는 내용으로 (재)범부처신약개발사업단과 범부처전주기신약개발사업과제 협약을 체결했다고 8일 밝혔다.
이번 협약으로 인투셀은 OHPAS 링커 기술이 도입된 후보물질을 도출하고, 공정개발을 진행할 계획이다.
박태교 인투셀 대표는 “이번 연구협약은 인투셀의 항체-약물 복합체 플랫폼 기술을 객관적으로 인정받는 계기가 됐다“며 “회사의 약물 복합체 관련 핵심 기술을 바탕으로 비소세포폐암 뿐만 아니라 미충족 의료 수요가 높은 여러 암종에 대한 글로벌 혁신신약을 선보일 것”이라고 말했다.
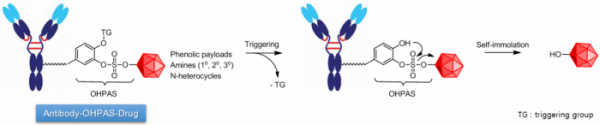
OHPAS 링커 기술은 혈중에서 안정적인 특성을 가지며, 타깃 암세포안에 들어갔을 때만 선택적으로 약물을 방출하게 된다. 가장 큰 차별성은 링커에 결합시킬수 있는 독성 화합물 범위가 넓다는 설명이다. 기존의 ADC 링커 기술은 주로 아민 계열의 약물을 이용하며, 페놀기 약물은 약물 구조를 변형해야하기 때문에 독성 항암효능이 떨어지는 문제가 있었다. ADC 항암제 개발시 언멧니즈가 있는 부분이다.
반면 OHPAS 링커는 기존의 링커기술로 결합시키기 어려운 아마니틴(amanitin), 듀오카마이신(duocarmycin) 등 페놀기를 갖는 약물구조를 변형하지 않고 붙일 수 있으며, 아민기 약물(1, 2, 3차 아민 및 N-heterocycles)에도 페놀기 스페이서를 붙여 적용할 수 있다. 또한 약물 합성공정이 효율적이라는 설명이다. 인투셀은 지난해 12월 OHPAS 링커 플랫폼에 대한 미국 및 PCT 특허출원을 마쳤다.
인투셀은 HER2 항체에 OHPAS 링커 기술로 벤조디아제핀(benzodiazepine)을 결합한 ADC를 만들어 테스트했다. 그 결과 기존의 링커가 혈중에서 링커가 분리되는 문제를 개선해 실제 환자에게 약물을 투여할 수 있는 농도범위(therapeutic window)가 넓을 것으로 기대하고 있다.
▲인투셀 OHPAS링커가 도입된 항체-약물 복합체의 약물방출 메커니즘, 인투셀 제공
인투셀이 타깃하는 신규 면역관문 분자인 B7-H3는 항원제시세포(Antigen-presenting cells, APC)가 발현하고 있는 면역관문 분자로 T세포 반응을 억제한다. B7-H3는 다양한 암종에 걸쳐 발현되며, 특히 비소세포폐암 환자 가운데 약 74%로 높게 발현하고 있다. 암 조직에서 B7-H3 발현이 높을수록 예후가 나쁘다. 최근 연구에 따르면 B7-H3는 PD-(L)1 약물 저항성을 나타내는 원인 인자로 꼽힌다. 따라서 기존의 면역관문억제제와 B7-H3를 병용투여하면 환자의 약물 반응률을 높일 수 있을 것으로 기대한다.
글로벌 수준에서도 B7-H3 ADC는 초기 단계다. 마크로제닉스(Macrogenics), 다이이찌산쿄(Daiichi-Sankyo) 등이 전임상을 진행하고 있으며, 아직 임상에 들어간 B7-H3 ADC 후보물질은 없다.
인투셀은 인간항체 라이브러리를 갖고 있는 와이바이로직스와 공동연구를 통해 B7-H3 인간 항체 후보물질을 찾았다. 와이바이오로직스는 자체적으로 확보한 naïve cDNA인간항체 scFv 파아지 디스플레이 라이브러리 'Ymax-ABL'를 보유하고 있는 항체 전문회사다. 인투셀 관계자는 "와이바이오로직스의 ADC를 위한 암특이적 항체는 생산성과 물성이 뛰어난 특성을 갖는다"며 "약물이나 링커 접합시 발생할 수 있는 구조적 안정성의 문제를 최소화할 수 있을 것"이란 설명이다.
한편 범부처전주기신약개발사업은 부처간 R&D 경계를 초월해 신약개발 분야를 지원해 온 국가 R&D사업으로, 2020년까지 글로벌 신약을 10개 이상 개발할 수 있는 사업 추진 체계 구축을 목표로 하고 있다.








