기사본문
[김태형의 게놈이야기]'AACR 2019'서 주목한 4가지
입력 2019-04-23 10:05 수정 2019-04-23 10:05
김태형 테라젠이텍스 상무
올해로 110회째를 맞는 전세계 최대 규모 암 연구 컨퍼런스 ‘AACR(American Association for Cancer Research) 2019’가 지난 3월 29일부터 4월 3일까지 6일간 미국 조지아주 애틀랜타의 '조지아 월드 콩그레스 센터(Georgia World Congress Center)'에서 열렸다.
올해 AACR은 현저히 임상시험 연구 결과 발표가 늘었다. 기초 암연구나 전임상 암연구 데이터 발표가 많았던 과거와 달라진 모습이다. 특히 난치성 암의 메커니즘을 이해하려는 새로운 시도가 많았으며 특히 면역항암제의 낮은 반응률에 대한 과학적 해명을 찾기 위한 임상시험 연구가 확연히 증가하였다. 올해 AACR에서 주요하게 다루어진 4가지 주제인 마이크로바이옴, 빅데이터, 바이오마커, 네오안티젠(신생항원) 치료에 관해 소개하고자 한다.
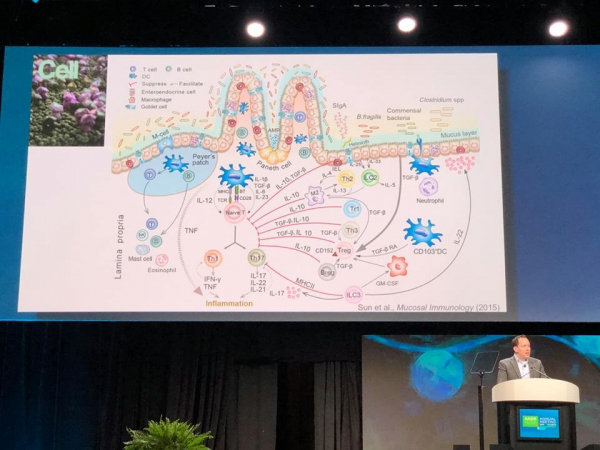
▲웨일 코넬 메디컬 대학의 그레고리 소넨버그 박사.
면역항암 치료 관련 마이크로바이옴 연구
개인적으로 이번 AACR에서 가장 뜨거운 주제는 단연 마이크로바이옴이었다.
플로리다 대학의 크리스틴 조빈(Christian Jobin) 박사는 암 치료와 관련된 마이크로바이옴 연구의 전반적인 역사에 대해 리뷰했다.
최근까지도 연구자들은 인체 유전자 약 2만 개에만 관심가졌을 뿐 인체 내 존재하는 200만 개 마이크로바이옴 유전자에 대해서는 관심이 없었다. 그러던 중 장내 미생물이 대장암에 있어서 'Microbial carcinogenic network(planktonic, biofilm organization, colibactin)'가 있음이 밝혀지면서 관심이 시작되다가 '제노크래프트(xenograft) 모델'에서 사람의 췌장암 이식이 성공했고 여기에 특정 박테리아가 핵심적으로 관여한다는 것까지 알게 되면서 종양과 마이크로바이옴의 관련성에 확신을 가지게 되었다. 그 결과로 최근 몇 년 사이 이러한 연구가 폭발적으로 진행되었다.
올해 발표된 연구내용을 보면 면역 항암 치료에 관여하는 마이크로바이옴을 마이닝하기 위한 임상연구가 활발히 진행되고 있는 것을 볼 수 있는데, 발견된 특정 미생물들이 면역 관문 억제제(ICB) 반응 군과 비 반응 군에 있어 어떤 차이를 보이는지에 관한 임상 결과들이 많았다.
그리고 최근 흑생종 및 폐암 환자 등과 같은 암환자들의 분변 마이크로바이옴을 분석하기 위해 NGS(차세대유전체해독) 기반으로 면역항암과 관련한 특정 미생물 군집의 16S rRNA를 분석할 수 있게 됨으로 인해 면역관문억제제 임상시험에 마이크로바이옴 분석이 루틴하게 활용할 수 있게 되었다.
이를 통해 이제는 인간의 2만개 코딩 유전자뿐만 아니라 체내 모든 200만개 마이크로바이옴들의 유전자들까지 들여다보면서 종양 발생에 있어 상호 관계를 밝혀내고 있다.
이번 AACR에서는 기조 강연 세션으로 항암치료 반응과 연관된 마이크로바이옴 관련 임상시험 연구 강연이 3건이나 있었다. 그 중 웨일 코넬 메디컬 대학의 그레고리 소넨버그(Gregory F. Sonnen-berg) 박사와 미국 암 연구소(National Cancer Institute)의 지오르지오 트린치에리(Giorgio Trinchieri) 박사가 항암 치료와 마이크로바이옴의 연관성에 대한 대규모 임상연구 결과들을 속속 발표하였다.
이로 인해 면역항암제 개발을 위한 임상시험 시 복잡한 미세종양환경을 고려하듯, 인체 내 약 100억 마리 이상 되는 장내 마이크로바이옴을 이용한 바이오마커 발굴 및 치료전략을 세워야 한다는 점에 있어서 전 세계 연구자들의 공감대를 형성한 듯 하다.
특히 지오르지오 트린치에리(Giorgio Trinchieri) 박사 발표의 경우 사람이 먹는 음식에 따라서도 미생물 환경이 많이 달라지기 때문에 시카고, 휴스턴, 파리 등 다양한 도시에 살면서 anti-PD1 치료받는 암환자들의 다양한 식습관을 고려한 임상시험 연구를 진행하고 있다고 발표했다.
파커 암 면역요법연구소(Parker Institute for Cancer Immunotherapy)의 크리스틴 스펜서 박사는 세계 최초로 FDA 규제 대상이 아닌 프로바이오틱스를 이용해 암환자를 대상으로 임상시험한 연구 결과도 발표했다.
기존 면역 관문 억제제의 암환자 반응률은 20~30% 정도로 극히 낮아 이를 개선하기 위해 암환자가 특정 음식, 음료를 피하거나 먹게 하여 면역관문억제제 반응률을 얼마나 높일 수 있는지 연구한 것인데, 113명의 전이성 흑색종 환자를 대상으로 그들의 분변 마이크로바이옴 분석을 통해 장내세균의 다양성에 대해 분석했으며 그들의 식이습관, 건강보조식품 및 약 처방에 대한 모든 정보를 계속해서 추적 조사하였다.
그 결과 면역항암제 반응이 낮은 하위 70%는 프로바이오틱스 복용 여부가 장내 세균의 다양성에 크게 관여함을 알게 되었다. 또한 섬유질을 많이 복용하는 환자들은 그렇지 않은 환자들에 비해 약 5배 이상 면역항암제가 잘 반응하는 것을 볼 수 있었다. 특히 통곡물(whole grain) 자체를 섭취하는 경우 면역항암제 반응이 더 좋았고 반대로 가공육이나 설탕이 첨가된 식품을 섭취한 경우 면역항암제 반응과 관련된 미생물이 적게 발견되었다.
이외에도 마이크로바이옴은 임상시험 시 환자들의 반응률을 예측하고 계층화하는 데 매우 유용하며 면역항암제에 반응하는 환자 또는 건강한 기증자의 분변이식도 가능케 한다. 항암제 반응을 위해 필요한 미생물들을 잘 유도하기 위한 식이요법과 프리바이오틱스 등을 찾아내는 데에 임상적으로 매우 유용한 여러 연구결과 발표도 있었다.
특히 anti-PD1에 반응하는 미생물을 정확하게 식별하고 동정하기 위한 연구가 급속히 증가하면서 마이크로바이옴 특성을 임상적으로 잘 검증하기 위한 코호트들이 많이 만들어 질 듯하다. 그러려면 표준화된 샘플 수집 방법, 박테리아 용해, 시퀀싱 및 분석에 대한 SOP 및 인프라를 잘 구축하는 것이 면역항암제 반응에 따른 마이크로바이옴 임상시험 연구에 있어 경쟁력이 될 것이다.
아니나 다를까 FDA는 이번 미국암학회에서 'FDA 201'이라는 주제로 발표한 내용 중 마이크로바이옴과 관련한 규제 가이드라인에 대해서 소개를 했다. 이를 간략히 정리하면 다음과 같다.
FDA 종양부서에서 장을 맡고 있는 케 류(Ke Liu) 박사가 'Regulatory Considerations for Gut Microbiota-based Cancer Therapy' 제목으로 발표했다.
류 박사에 따르면 미국 내 IND 승인을 받고 진행되는 장내 세균 임상시험 1/2 상이 약 10개(올해 3월 16일 기준) 정도 된다고 한다. 이들 임상시험은 대부분 anti-PD1 치료와 관련한 분변 미생물 이식(FMT) 및 마이크로바이옴 임상시험이 대부분이었으며 흑색종, 신장암, 폐암, 전립선암, 중피종 암종에 대해서 연구 중이었다.
FDA는 1순위로 FMT시 일관된 프로세스와 다른 미생물과 바이러스가 오염되지 않게 유지하는 전체 생산과정을 집중적으로 검토하겠다고 했다.
현재 미국에서 진행되고 있는 초기 임상시험 결과들이 나오게 되면 많은 기준이 정립될 것 같고, 이를 통해 이후 신약개발에 크게 도움이 될 듯하다. 이들 임상시험 결과들을 유심히 볼 필요가 있을 것이다.

▲에모리 대학 리 쿠퍼 박사의 발표 내용.
빅데이터 및 인공지능 기술을 이용한 암연구
올해 미국암학회에서는 인공지능 기술을 기반으로 암환자 이미지 데이터를 학습해 디지털 병리(digital pathology)를 구현하는 세션들이 많이 있었다. 매년 이 분야가 엄청난 속도로 확장되고 있음을 체감했다.
PathAI의 공동창업자이자 CEO인 병리의사 출신의 앤드류 백 (Andrew H. Beck) 박사가 발표한 인공지능 기술을 이용한 병리 이미지 분석 연구 내용 소개가 있었다.
앤드류 백 박사가 소개한 과거 연구 결과에 따르면 피부 생검 이미지를 해석하는 데 참여한 187 명의 병리의사 중에 45% 서로 해석의 불일치를 보였다고 한다. 같은 검체를 8개월 후 118 명의 병리의사가 다시 참여했을 때에도 33%의 불일치를 보였다고 한다. 복잡하고 해석하기 어려운 병리 이미지 데이터에 대해서 일관성 있는 결과를 내기란 매우 어렵다는 점을 소개했다.
그러면서 자신들의 딥러닝을 통한 전이암 진단 결과를 소개했다. 특정 대회에 참가한 병리의사들은 약 3.5%의 에러율을 보였으며 실제 임상현장에서는 약 13%에서 26%까지 에러율이 높아지는데 종양의 미세 전이를 판별하는 경우는 에러율이 현저하게 높아 약 23%~42%까지 에러율이 높아진다. 하지만 PathAI의 딥러닝 모델을 활용했을 때는 0.65% 에러율을 기록했다고 한다. (Camelyon16, JAMA 2017 발표)
병리학에 있어 인공지능 연구는 약 30년 정도 진행되어 왔지만 지난 5년 동안 주요 발전들이 모두 일어났다고 한다. 그 이유를 다음의 세 가지 관점에서 소개했다. 첫 번째로 대규모 라벨링된 병리 이미지 데이터가 이용 가능해졌으며, 두 번째로 고성능 병렬 프로세싱이 가능한 GPU 머신을 사용할 수 있게 되었다. 마지막으로 머신러닝/딥러닝의 현격한 개선으로 기존에 해결하지 못한 문제들을 해결할 수 있게 되었다고 했다. 앞으로 더욱 더 대용량의 데이터를 빠르고 정확하게 분석하는 기술로 암 연구 및 임상 진단에서 큰 발전들을 보일 것으로 예상된다.
에모리 대학교(Emory University)의 Lee Cooper 박사는 구글 이미지넷(ImageNet)에 1400만 개의 해석된 이미지(annotated image)가 있고 이를 이용해 다양한 이미지 학습을 통해 계속해서 이미지 판별 성능이 개선되고 있음에 착안하여 딥러닝 기술로 디지털 병리(digital pathology)를 구현하기 위해 전 세계 병리학자 또는 연구자들을 대상으로 집단 협업 방식으로 이미지를 라벨링하고 공유하는 것을 제안하였다. 이를 통해 현재 5개 국가, 25개 연구그룹이 참여해 5만 개 이상의 라벨링 된 암환자 이미지 데이터를 구축했다고 한다. 더 나아가 전문가 그룹의 참여를 통해 비전문가들도 트레이닝하여 더 많은 대량의 라벨링 이미지 데이터를 수집하는 전략을 수립했고 추진하고 있다고 했다. (Bioinfor-matics 2019.2 발표)
또한 이 그룹에서는 유전체 데이터와 병리 이미지 데이터를 병합해 뇌종양 환자의 생존율을 분석했는데 병리이미지와 유전체 두 데이터를 병합하여 분석했을 때 뇌종양 환자의 생존율 예측 정확도가 매우 높았으며 특히 Survival Convolutional Neural Network(SCNN)라는 딥러닝 기술을 이용해 예측할 경우 병리의사가 직접 보고 판단할 때 보다 예측 정확도가 높았다고 발표했다.

▲펜실베니아 대학의 존 훼리 박사 발표 내용.
복잡한 암환자 계층화와 조기진단을 위한 바이오마커 연구
첫 기조강연 세션에서 펜실베이나 대학교(University of Pennsylvania)의 존 훼리(John Wherry) 박사가 면역세포 치료에 있어서 면역세포 프로파일링과 반응하지 않는 종양(cold tumor)의 대표적인 현상인 T 세포 고갈을 정확하게 동정하기 위한 바이오마커 연구에 대해서 발표했다.
발표 도입부에 현재 PD1/PD-L1 저해제 임상시험이 2250개가 진행되었거나 진행되고 있으며 이 임상시험을 통해서만 이미 40만 명 이상이 이 면역항암제를 처방받아 치료를 받았다고 소개했다.
그런데 아직도 이 면역항암제에 반응하는 환자 그룹과 저항성을 가지는 그룹을 정확하게 예측하고 구분하지 못한다고 전하며 환자 치료와 신약개발의 효율성을 높이기 위해서라도 지금보다는 스마트한 새로운 바이오마커가 필요하다고 했다.
다양한 면역항암치료를 위해 적합한 면역 프로파일링 방법들(고차원의 유세포 분석, RNA-Seq, ATAC-Seq, TCR-Seq, 마이크로바이옴, 종양 변이 부담 등)에 대해서도 언급했다.
이를 통해 주요 세포들의 타입을 동정하고 면역세포 치료 반응성을 예측해야 하며 더 나아가 이들 메커니즘을 이해하기 위해 새로운 임상시험을 통해 증명해 나가야 할 것을 강조하였다. (webcast: https://webcast.aacr.org/p/2019annual/19?sf100812637=1)
이번 미국암학회에서 발표된 면역항암제 & 바이오마커 기반 임상시험 중 MYSTIC 임상시험의 경우 PD-L1(durvalumab)과 CTLA-4(tremelimumab) 병용 치료를 mNSCLC 환자를 대상으로 진행하는데, 높은 종양 변이 부담을 가진 환자들이 생존율이 높다는 것을 발견했다.
게다가 bTMB(Blood Tumor Mutation Burden, 혈액기반 종양변이부담)라는 액체생검 방식으로 이를 측정하였다. 컬럼비아 대학교(Columbia University)의 나이어 리크비(Naiyer Rizvi) 박사는 전체 800명의 환자에서 각 환자 치료 그룹당 250명씩 할당해 연구를 진행했으며 bTMB가 16개/Mb 이상일 경우 높은 생존율을 보임을 확인하였다. 기존 화학항암제의 경우 2년 생존율이 19%인 반면, 면역항암제 치료 환자 중 >20개/Mb일 경우 약 48%까지 생존율이 높아짐을 확인하였다.
수많은 면역항암제 임상연구 중 MYSTIC trial을 통해서 종양 변이부담(TMB)이 20 개/Mb 이상 발견될 경우 면역항암제로 치료받는 환자들에게 최고의 이득이 돌아감을 알게 되었다.
하지만 이렇게 높은 종양변이부담을 보이는 환자의 비율이 아주 높지는 않아 주의할 필요가 있을 듯 하다.
그 외 바이오마커 연구 중에 현재까지 밝혀진 100여 가지 바이오마커를 조합해서 스크리닝하면 초기 단계 난소 암환자 전체 여성의 80% 정도를 진단할 수 있는 기술 발표도 있었다.
올해 액체 생검 발표가 특히 많았으며 비침습적으로 암을 조기에 검출하는 효과적인 검사법들이 많이 소개되었다. 암세포와 면역세포를 개별적으로 분석할 수 있는 싱글 셀(Single cell) 기술을 적용한 연구 결과 발표도 많이 있었다.
특히 미세 종양 환경 내 세포 간의 공간적 관계와 상호작용을 이해할 수 있는 3차원 히트맵(heat map)을 구현한 연구 결과 발표도 있어 복잡한 미세 종양 환경을 좀 더 이해하는 단계까지 올라왔음을 알게 되었다.
이를 통해 보덴밀러 (Bodenmiller) 랩에서는 유방암 환자 194명의 샘플에서 면역치료에 반응하지 않거나 내성이 생기는 미세 종양 환경 기작들을 분석하기 위해 2600만 개 단일 세포 분석을 통해 면역-암세포의 관계를 모두 분석하였다.
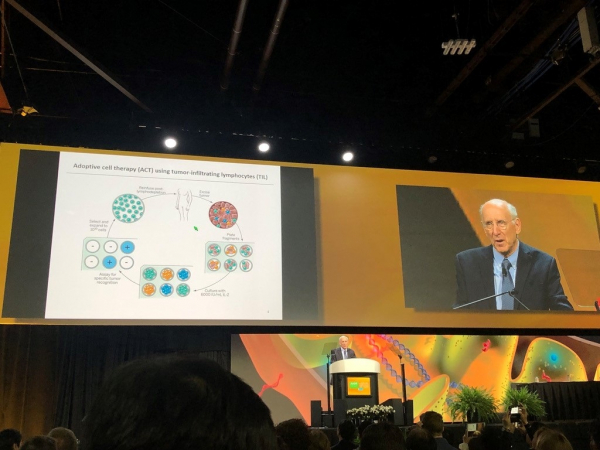
▲미국 암 연구소의 스티븐 로젠버그 박사
네오안티젠 기반 T세포 치료 전략
미국 암 연구소(National Cancer Institute)의 스티븐 로젠버그(Steven Rosenberg) 박사가 환자 개인별로 다양하게 발생하는 체세포 변이에 맞춰 개인 맞춤 T세포 치료를 제안하는 훌륭한 기조강연이 있었다.
그는 TIL(tumor infiltrating lymphocytes)이 생체 내에서 흑색종 세포를 어떻게 인지하여 파괴하느냐는 질문으로 강연을 시작하였다.
여기에 대한 답으로서 TIL이 정상세포는 피하고 특정 암세포만을 인지하여 타겟으로 삼기 위해서는 암환자 특이적 체세포 변이가 그 역할을 할 수 있다고 한다.
이러한 암환자 특이적 돌연변이는 세포 내에서 9~11개 정도 되는 아미노산 펩타이드를 형성하고 암세포의 네오안티젠으로서의 기능을 하며 개별 암환자 특이적 MHC에 적합하게 결합함으로써 면역원성을 가진 암 변이로 강력한 기능을 하게 된다. 그래서 이렇게 개인별로 특이하게 발현되는 네오안티젠이 그 역할을 하게 될 것으로 예상된다고 했다.
그러면서 흑색종 환자 22명을 임상시험한 결과를 소개했는데 이들은 개별적으로 평균 318개 정도의 네오안티젠이 발견되었고 모두 합쳐서 1만3664개였지만 항원성을 가진 네오안티젠은 끝내 54개 정도였으며 이를 통해 환자 중 약 82% 정도가 TIL치료에 반응했다고 한다. 그런데 매우 흥미로운 것은 이들 항원성을 가진 네오안티젠이 22명 환자 누구에서도 서로 공유하지 않고 개별 환자에게서만 발견되었다고 한다.
그래서 다양한 상피암(epithelial cancer) 관련 9개 암종(대장암, 췌장암, 유방암, 폐암, 위암, 난소암 등)을 가진 99명 환자를 대상으로 연구를 확장하니 최종적으로 197개의 항원성을 가진 네오안티젠이 예측되었으며 이를 치료에 활용하였더니 평균 약 81% 정도가 암세포가 줄어드는 반응을 보였다고 한다.
그런데 마찬가지로 이들 197개 네오안티젠 중에 KRAS 관련된 항원 2개를 제외하고는 99명 환자 단 한 명도 서로 공유하지 않았다고 한다.
이를 통해 2개의 가설을 세울 수가 있었는데 첫 번째는 고형암에서 대부분의 면역치료는 사실 환자에서 무작위로 형성되는 체세포 변이를 인식하는 것으로부터 시작한다는 것이며, 두 번째 가설은 세포 내 모든 단백질은 잠재적으로는 암 항원이 될 수 있다는 것이다.
그렇다면 나쁜 소식과 좋은 소식 두 가지를 우리에게 전할 수가 있는데 나쁜 소식은 면역기반 항암치료에 있어 개별적으로 모든 암환자를 치료하는 전략을 수립하고 방법들을 찾아야 하는 복잡성이 매우 증가되는 치료가 수반된다는 것이고, 반면 좋은 소식은 앞으로는 모든 암환자들을 위한 치료제가 생긴다는 것이다. 로젠버그 그룹에서 이번 22명의 흑색종 환자와 99명의 9개 고형암 암종의 환자 임상시험 결과로서 보여줬던 평균 약 80% 이상의 항원성 네오안티젠 반응률은 이를 증명하는 것이다.
내년 미국암학회 AACR은 미국 캘리포니아주 샌디에이고에서 개최될 예정이다. 매년 급속히 발전하는 암치료 및 진단과 관련된 훌륭한 임상연구 결과를 보면서, 내년에는 어떤 멋진 연구 결과 발표가 있을지 벌써부터 기대가 된다.







