기사본문
데시페라, 위장관기질종양 3상서 '1차종결점 PFS' 충족
입력 2019-08-14 14:26 수정 2019-08-14 14:27
바이오스펙테이터 봉나은 기자

데시페라 파마슈티컬스(Deciphera Pharmaceuticals)는 13일(현지시간) 진행성 위장관기질종양(GIST) 치료제 후보물질 ‘리프레티닙(ripretinib)’의 INVICTUS 임상3상(NCT03353753) 결과를 발표했다. 위약 대비 무진행생존기간(PFS)을 개선해 1차 종결점을 충족한 긍정적인 결과다. 데시페라는 2020년 1분기 미국 식품의약국(FDA)에 승인을 위한 서류(filing)를 제출할 계획이라고 밝혔다. 이번 발표로 데시페라의 주가는 한때 115% 이상 급등하기도 했다.
리프레티닙은 KIT 및 PDGFRα를 타깃하는 인산화효소 저해제(KIT/PDGFRα kinase inhibitor)로, 1일 1회 복용하는 경구제(150mg)로 개발됐다. 데시페라는 KIT나 PDGFRα 유전자의 돌연변이로 발병하는 위장관기질종양, 전신비만세포증(SM), 고형암 등과 같은 암 치료에 리프레티닙이 효능을 보일 것으로 전망하고 있다.
데시페라는 이번 INVICTUS 임상에서 이전에 이마티닙(imatinib), 수니티닙(sunitinib), 레고라페닙(regorafenib)으로 치료받은 경험이 있는 진행성 위장관기질종양 환자 129명의 4차 치료제로 리프레티닙의 효능을 평가했다. 환자는 2:1 비율로 나뉘어 경구용 리프레티닙 150mg 또는 경구용 위약을 처방받았다. 데시페라는 1차 종결점으로 무진행생존기간(PFS)을 평가하고, 2차 종결점으로 객관적 반응률(ORR), 전체생존율(OS), 종양이 진행되는 시간(Time to Tumor Progression, TTP) 등을 평가했다.
그 결과, INVICTUS 임상에서 리프레티닙 치료군의 무진행생존기간(PFS) 중간값은 6.3개월(27.6주), 위약 치료군의 PFS 중간값은 1개월(4.1주)로 확인됐다. 리프레티닙이 위약 대비 질병 진행이나 사망 위험성을 85%까지 유의미하게 감소시킨 결과로, 1차 종결점을 충족한 것이다. 객관적 반응률(ORR)은 리프레티닙 치료군이 9.4%, 위약 치료군이 0%였지만, 통계적으로 유의미하진 않았다(p-value=0.0504). 전체생존율은(OS) 리프레티닙 치료군, 위약 치료군에서 각각 15.1개월(중간값), 6.6개월(중간값)로 확인됐다.
(바이오스펙테이터 재구성)
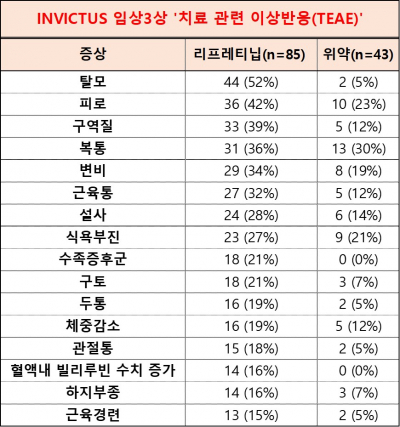
리프레티닙은 잘 통제됐으며, 이전 임상1상과 일치하는 이상반응 결과를 보였다. 3, 4등급의 치료 관련 이상반응(TEAE)은 리프레티닙 치료군의 49%(42명), 위약 치료군의 44%(19명)에게서 나타났다. 리프레티닙 치료군에서는 빈혈증(8명), 복통(6명), 고혈압(6명)이 주로 발생하고, 위약 치료군에서는 빈혈증(6명)이 주로 발생했다.
Steve Hoerter 데시페라 대표는 “이번 INVICTUS 임상 결과는 리프레티닙이 위장관기질종양 치료를 변화시킬 수 있는 잠재력을 보인다”며, “현재 승인된 치료제에 실패해 다른 치료옵션이 절실한 환자를 위해 리프레티닙이 평가될 수 있도록 FDA와 긴밀히 협력하는데 중점을 두겠다”고 말했다.
이번 긍정적인 INVICTUS 임상 결과 소식에 리프레티닙의 다음 임상도 긍정적일 것으로 회사측은 기대하고 있다. 현재 데시페라는 이전에 이마티닙으로 치료받은 경험이 있는 진행성 또는 불내성(intolerant) 위장관기질종양 환자를 위한 2차 치료제로 ‘리프레티닙’과 ‘수니티닙’을 비교하는 Intrigue 임상3상(NCT03673501)을 진행 중이다. 화이자의 ‘수텐트(Sutent, 성분명: 수니티닙)’는 위장관기질종양 환자의 2차 표준 치료제로 처방되고 있다.







