기사본문
셀트리온, 허쥬마 3년 추적조사서 '효능·안전성' 확인
입력 2019-09-27 07:24 수정 2019-09-27 07:25
바이오스펙테이터 바르셀로나(스페인)=장종원 기자
셀트리온이 항암 항체 바이오시밀러 '허쥬마(Herzuma)'의 3년 장기추적 조사를 통해 오리지널의약품과 동등한 효능 및 안전성을 확인했다. 허쥬마는 2018년 2월 유럽을 시작으로 미국, 캐나다, 일본, 브라질, 호주 등 각국으로 허가를 확산하고 있다.
셀트리온은 오는 29일(현지시간)스페인 바르셀로나에서 열리는 유럽종양학회(ESMO 2019)에서 허쥬마의 3년 장기추적 조사를 발표한다. 2014년 6월부터 프랑스, 이탈리아 등 세계 22개 국가서 이뤄진 허쥬마 임상 3상에 참여한 HER2 과발현 조기유방암 환자 549명을 추적조사한 결과다.[NCT02162667]
앞서 공개한 초록을 살펴보면 허쥬마(성분명 트라스투주맙)는 3년간(평균 39개월)의 추적연구에서 오리지널의약품인 허셉틴과 장기 효능 및 안전성에서 유사한 결과를 얻었다.
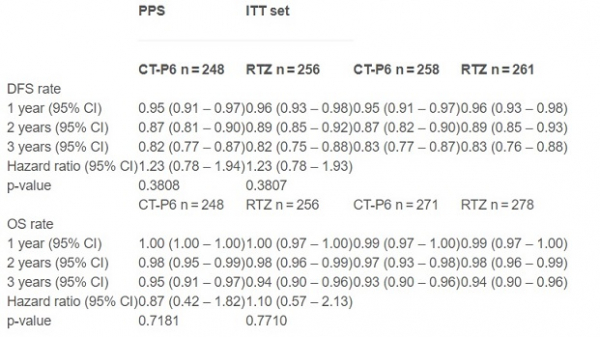
연구는 PPS그룹(임상시험에서 치료를 완료한 피험자군)과 ITT그룹(모든 피험자군)으로 나눠 허쥬마와 허셉틴의 무병생존율(disease-free survival, DFS)과 전체 생존율(overall survival, OS)을 추적했다.
먼저 PPS그룹에서 허쥬마의 3년 DFS는 82%로 허셉틴의 82%와 같았고 ITT그룹(모든 피험자군)에서도 각각 83%, 83%로 동등한 결과를 냈다.
OS도 마찬가지로 PPS그룹에서는 95%, 94%로 ITT그룹에서는 93%, 94%로 유사한 결과를 확인했다. 좌심실박출률(LVEF)은 두그룹에서 모두 60%를 초과했으며(50% 미만으로 떨어지면 투약 중단) 추적기간 동안 새로운 심부전 사례는 보고되지 않았다.
연구진은 "39개월의 추적 관찰 결과 DFS, OS는 비롯해 심장독성 등에서 허쥬마와 허셉틴의 유사성을 확인했다"고 설명했다.
허쥬마는 이러한 연구결과를 바탕으로 각국으로 허가와 판매를 확대하고 있다. 허쥬마는 2018년 2월 유럽 허가 이후 미국, 캐나다, 일본, 브라질 등으로 허가, 판매국을 늘려가고 있다. 최근에는 이라크 내 자치구의 입찰을 통해 허쥬마의 중동지역 진출 물꼬를 열었다.







