기사본문
[BioS 레터]RNAi 치료제의 지속적인 문제 해결
입력 2020-08-06 09:54 수정 2020-08-06 16:29
이의정

(The current state and future directions of RNAi- based therapeutics, Ryan L. Setten et all. 2019, Nature Reviews Drug Discovery ,volume 18, p421–446)
`RNA 간섭(RNA interference, RNAi) 치료제`는 차세대 미래 신약 기술로 인정받고 있는 유전자 치료제 중 하나로, 모든 유전자의 발현을 억제시킬 수 있기 때문에 암과 난치질환을 포함한 다양한 질병에 적용 가능한 새로운 해결책으로 여겨지고 있다. 1998년 Andrew Fire와 Craig Mello이 post-transcriptional gene silencing을 일으키는 RNA(dsRNA)를 발표한 후, 그로부터 8년 후인 2006년 RNAi 기술로 노벨 생리의학상을 받으며 많은 기대를 받게 되었다. 현재도 이 분야는 많은 회사들이 RNAi 기술을 가진 잠재적 치료제를 개발하는데 총력을 기울이고 있을 만큼 지속적인 발전을 보여주고 있다.
RNAi 현상은 합성된 small interfering RNA(siRNA)를 세포 안에 세포내이입(endocytosis)를 통하여 세포질로 들어가면서 시작된다. siRNA는 세포질에서 RNAi 효소인 Dicer과 TAR RNA- binding protein(TRBP)와 결합하게 되고, Argonaute-2(Aro2)가 이 결합체와 함께 RNA- induced silencing complex(RISC)-loading complex(RLC) 복합체를 이루어 이중가닥이었던 siRNA를 단일가닥으로 자르게 된다. 단일가닥이 된 siRNA 복합체는 성숙한 RISC 복합체와 결합한 후, 타깃 mRNA 센스 가닥에 상보적으로 결합해 분해시키고 최종적으로는 단백질의 형성을 방해한다.
이 RNAi 발현 조절 기전은 최근 치료를 위해 암은 물론 안과 질환, 대사 질환, 바이러스 감염과 같은 다양한 질병에 관련 연구들이 진행 중에 있다. 암 치료제 같은 경우, 이미 알려진 암 특이적 유전자들을 RNAi 기술로 억제하여 암세포의 성장과 증식, 그리고 전이에 대해 부작용을 최소화하면서 치료를 가능하게 한다. 또한 치료제가 없었던 난치질병이나 기존의 약물 치료가 어려웠던 질병들에 대해서도 RNAi 치료제는 새로운 해결책으로 부상하고 있다.
이러한 장점에도 불구, RNAi 치료제 개발에서 가장 중요한 도전은 비특이적 독성을 피하는 것이라고 할 정도로 RNAi 독성(toxicity)에 대한 장애물들이 존재한다. RNAi 치료제 독성의 원인은 주로 4가지로 나뉜다. 첫번째는 긴 이중 가닥 RNA(double-stranded RNA, dsRNA)에 대한 면역반응이다. PKR, Toll-like receptor2(TLR3)와 TLR7에 의해 dsRNA에 대한 면역반응을 일으키게 되었지만, 현재 이 문제는 당의 2ʹ-O- methyl base 변형으로 해결이 가능해졌다. 두번째는, 부형제(excipient)의 독성이다. 이는 나노입자(nanoparticle) 약물 제형을 까다롭게 하고, 나노입자 약물 후보들이 독성으로 인해 약물 투여량이 제한될 수 있는 가능성을 갖는다. 또한, 임상시험에서 부형제의 구성성분이나 부형제가 물질대사로 분해되는 등의 문제도 보여지고 있다. 세번째로는 의도하지 않게 off-target 효과가 발생할 가능성이 존재한다는 것이다. 이는 인간 게놈 시퀀스(human genome sequences)를 스크리닝하여 BLAST와 겹치는 타깃 부위 시퀀스는 후보군에서 제외하는 방법으로 개선할 수 있지만, 광범위한 테스트를 하여 안정성을 확보해야 하는 단점이 있다. 마지막으로는 다른 기관(organ) 및 조직(tissues)에서 on-target RNAi 활동을 보이는 것이다. 매우 가능성이 높은 질병 타겟 gene을 선택하면서 이 장벽은 낮아졌지만, 특이적으로 질병 원인 위치로만 전달되는 부분은 앞으로도 계속 개선이 필요한 부분이다.
본 글은 이러한 문제점을 극복하고 있는 몇가지 기술들을 살펴보고자 한다. RNAi 한계를 극복하기 위해, 고분자 나노입자(nanoparticles), LNPs, aptamers, molecular ligands, oligonucleotide 염기(base)와 백본(backbone) 변형과 같은 잘 확립된 기술들이 연구되고 있다. 또한, 전신(systemic) 및 국소(local) RNAi 전달 및 RNAi payload 특이성과 안전성에서 기존의 패러다임을 바꿀 수 있는 새로운 접근법을 개발 중에 있다.
Endosomal 탈출의 증가
Endosomal 탈출(escape)은 간(liver) 질병 관련 RNAi 기반 치료제의 확장에 큰 장벽이다. 세포내이입(endocytosis)으로 세포 내로 들어온 siRNA가 세포질로 탈출하지 못하고 lysosome에서 분해되면서, endosomal 탈출은 효율적인 siRNA 전달의 주요 장애물로 나타나고 있다. 최근 리뷰 논문들에서는 수동적으로 siRNA가 endosome을 탈출하는 비율이 0.01%보다 작고, 표적 knockdown을 위해 약 2,000~5,000개의 세포질에 siRNA가 필요하다고 보고된 바 있다. 더하여, 대부분의 표면 수용체의 recycling 주기는 세포질에서 siRNA가 타깃 부위에 도달한다 해도 치료효과는 기대할 수 없는 장벽 중 하나로 보여진다.
이에 대한 해결방안으로 GalNAc(N- acetylgalactosamine)-siRNA 결합체가 고안되었는데, GalNAc-siRNA 결합체는 siRNA 분자에 3개의 GalNAc분자를 연결하여 안정성을 높였을 뿐만 아니라, 간세포에 많이 존재하는 당단백질 수용체가 이 분자를 인식하게 함으로써 타깃 기관인 간으로 전달성을 높인 방법이다. 이 방법은 간을 목표로 하는 미래의 RNAi 기반 치료법에 좋은 소식이지만, 다른 세포 및 기관에 대해서는 여전히 해결되지 못한 문제이다. 이 외에, endosome을 파괴하는 대안으로 AB5 toxin family members으로부터 영감을 얻은 세포 역행 수송을 이용할 수도 있는데, 여러 논문에서는 이 전략이 세포 실험에서 표적 유전자 knockdown에 성공했다고 보여지고 있다. 이 아이디어는 현재 개발 초기 단계에 있지만, endosomal 탈출에 대한 새로운 비 독성 접근법으로 RNAi 치료제의 적용을 넓히는 데 분명히 도움이 될 것이라고 보여진다.
항체-siRNA 결합체
항체(antibody)와 siRNA의 결합 기술은 치료제의 효능과 안전성을 높이고, 전신 순환과 표적 전달을 개선하는데 기대가 되는 연구이다. 면역글로불린 G(Immunoglobulin G, IgG) 항체는 전체 순환과 전신 조직 분포를 확장하는 특권을 가진 거대분자로, IgG-siRNA 결합체는 siRNA와 변형된 IgG와의 비공유적 상호작용 또는 리신(lysine)이나 시스테인(cysteine) 잔기와의 공유 결합으로 형성된다. 최근, Avidity Biosciences는 단일 IV 투여 후, 생체 내 불특정 근육 조직에서 myostatin mRNA의 90% knockdown을 달성한 항체-siRNA 결합체를 발표하였다. 이 연구의 세부 사항 및 검토가 확실시 된다면, siRNA를 간 이외의 조직으로 이 전략으로 RNAi 치료제의 개선이 가능 하다는 것을 증명할 수 있을 것이다. 현재 Avidity의 IgG-siRNA 결합체는 Duchenne 근이영양증(muscular dystrophy) 및 근위축성 이영양증 유형 1(myotonic dystrophy type 1)에 대한 개발 중에 있다.
소수성 siRNA를 이용한 효능 향상
대사적으로 안정화된 siRNA 효능 증가에 대한 이슈는 소수성(hydrophobic) 변형(예: Phio’s sd-rxRNAs)을 가진 siRNA에도 새로운 관심을 보이고 있다. 최근 보고된 내용에 따르면 콜레스테롤과 결합된 phosphorothioate(PS)-modified self- delivering siRNA의 효능을 향상시킬 수 있는 특정 모티프를 밝혀냈으며, 이 응용 연구에서 전체적으로 변형된 siRNA의 우수한 효능을 보여주었다. 변형된 불용성 FMS-like tyrosine kinase 1(FLT1) siRNA는 소수성 변형(한 쪽 끝에는 콜레스테롤, 다른 쪽 끝에는 짧은 PS 변형 단일 가닥 RNA overhang의 모습)을 보였으며, 표적이 없는 siRNA의 광범위한 조직 분포와 강력한 RNAi silencing은 동물실험에서 긍정적인 결과를 나타냈다. 최근의 보고에 따르면 비콜레스테롤 지질 결합체를 가진 형태는 CNS와 다른 간 이외의 조직에서도 적용 가능성을 보여주었다. 영장류에서의 긍정적인 연구 결과를 통해, 소수성 siRNA 치료제가 곧 임상 단계에 들어갈 수 있지 않을까 기대해본다.
입체 선택성 phosphorothioate 합성
phosphorothioate(PS) 입체 화학구조가 antisense oligonucleotide(ASO)의 약리학적 특성에 실질적으로 영향을 미친다는 것은 이미 증명 된 바 있다. 대사적으로 안정화된 siRNA와 소수성으로 변형된 siRNA에서 변형의 사용이 증가하게 되면서 단점도 생기게 되었는데, 이는 각 PS 변형이 두 개의 가능한 비대칭 구성(Sp와 Rp)을 가진 스테레오 센터(stereo centre)를 갖게 된다는 것이다. 두 비대칭 구성의 방향은 다른 약동학 특성과 다른 약력학 특성을 가지고 있다. Sp-oriented PS 연결은 Rp에 비해 핵산 분해 효소 분열에 대한 더 나은 저항성을 제공하고, 약리학적 비활성화로부터 입체화학적 보호가 가능하다. 이와 같은 분자 이질성(heterogeneity)은 종종 임상 개발에 어려움을 주기 때문에, RNAi 치료제는 더욱 발달된 PS-modified oligonucleotides의 입체 선택적(stereoselective) 합성이 개선된 기술이 필요하다.
LNPs의 독성 감소
lipid nanoparticle(LNP)가 기반된 RNAi 치료제로서의 ONPATTRO(patisiran)의 성공은 여전히 LNP에 대한 발전이 있을 수 있음을 시사한다. 그러나, 이온화 지질 부형제의 독성은 복용량의 최대치와 장기간 사용에서 허용 가능한 용량에 대한 문제는 아직 우려되고 있다. 이러한 문제를 피하기 위해, 연구원들은 에스테르(ester) 그룹을 지질의 소수성 꼬리에 연결함으로써 이온화 지질의 대사 분해를 용이하게 하려고 시도하고 있다. 예를 들어, 한 논문에서는 분해 가능한 에스테르가 포함된 이온화 지질을 이용한 anti-PCSK9 siRNA를 원숭이 모델에 주입했을 때, 90%의 silencing 효과를 보여주었다. 에스테르를 가진 이온화 지질을 포함하는 대체 전략에 대한 긍정적인 결과가 보고되었고, ONPATTRO의 FDA 승인과 안전과 효능에서의 잠재적인 성공은 새로운 지질 RNAi 치료제에 대한 더 많은 관심을 불러일으킬 것이다.
siRNA 전달을 위한 엑소좀 이용
최근 엑소좀(exosome)은 전신 RNAi 전달을 위한 전달체로서 상당한 가능성을 보여주었다. 엑소좀은 내인성 세포(endogenous cell)에 의해 생성된 천연 나노입자로 microRNA(miRNA)와 같은 물질을 말단 조직으로 운반하는 역할을 한다. 엑소좀은 식세포 작용으로부터 세포를 부분적으로 보호하는 기능을 갖는 CD47과 다른 내인성 신호 ligands가 포함되어 있는 큰 장점을 갖는다. 이를 통해 MPS(mononuclear phagocyte system)가 제거되는 것을 억제하고 세포 흡수를 개선함으로써 전신 순환 반감기를 증가시킬 수 있다. 현재 Codiak Biosciences은 면역 종양과 자가면역 표적을 위한 엑소좀 전달 siRNA의 임상 전 개발을 수행하고 있으며, M. D. Anderson 암 센터는 췌장암에 대한 엑소좀 전달 anti-KRAS siRNA를 시험하는 1단계 임상시험을 등록했다.
지역 배달 강화
RNAi payloads의 국소적(local) 표적 전달은 체계적인 전달의 어려움을 위한 해결 방안이 될 수 있다. 이에 대한 한가지 중요한 과제는 국소 영역 내에 RNAi 치료제를 유지시키는 것인데, 최근 층별 electrostatic assemblies와 주입 가능한 생분해성 하이드로겔(hydrogel)에 대한 연구는 치료 효과를 위한 siRNA의 국소 방출을 확장시키는데 있어 미래가능성을 보여준다. 이 연구는 현재 아직 초기연구에 있지만, 상처 치유 및 조직 재생에 적용 가능한 연구들이 보고된 바 있다. 더하여, 점막의 국소적인 적용을 위해 높은 밀도의 점액을 이기기 위한 주요 문제도 해결 중에 있다. 점액은 밀도가 높은 고분자 겔 구조를 가지고 있어 약물과 점막 세포와의 효과적인 상호작용을 방해한다. 최근 논문에서는 중성 전하(charge)와 친수성 표면 코팅을 가진 나노입자가 점액을 관통하여 효과적으로 하부 조직에 도달할 수 있다는 것을 보여주었다. 이 연구는 현재 폐, 위장 및 기타 조직에 대한 RNAi 전달을 크게 향상시킬 수 있을 것으로 예상된다.
핵산 나노구조체
나노입자(nanoparticles)의 주요 장벽은 나노입자 고유의 화학적, 물리적 이질성이었다. 최근 DNA 및 RNA 나노 기술의 개발을 통해 정확한 분자 구성, 명확한 모양 및 크기, 표면 리간드(ligand)의 수, 유형, 패턴 및 심지어 방향에 대한 정확한 컨트롤이 가능해지면서 siRNA 운반 나노구조를 만들 수 있는 능력을 만들어 내었다. 더하여, 핵산 나노구조체(Nucleic acid nanostructures)는 국소 부위의 생화학적 신호에 직접적으로 반응하도록 설계되어 특정 타깃에 운반이 가능하다.
이러한 장점들에도 불구하고 아직 주요 장애물이 남아있는데, 핵산은 마이너스 백본(backbone) 전하를 가지고 있어 전신 순환으로부터의 분해가 가속화 될 수 있다. 또한, 본래의 DNA와 RNA는 혈청 핵산분해효소(serum nuclease)에 취약하며 면역적인 독성을 유도할 수 있다는 단점이 있다. 하지만 독성을 감소시키고, 핵산 내성 증가를 위해 핵산 나노구조체를 변형시키거나 지질 혹은 펩타이드 기반 코팅과 같은 보호 보조제를 첨가함으로써 이러한 단점을 극복하고 있다. 현재로서는 이 기술이 아직 학문적 연구 단계에 있지만, 이러한 노력은 궁극적으로 RNAi 전달을 위해 분자적으로 명확하고 다기능적인 나노구조를 만들어 낼 것 이다.
이 외에도 RNAi 활성을 반대로 이용하여 특정 RNAi 치료제에 대한 부작용을 억제하는 방법, nucleic acid switches를 이용한 조건부 RNAi 활성 방법 등이 연구가 활발하게 진행되고 있으며, 대체 전임상모델로서의 organoids와 organ-on-a-chip technologies의 개발은 사람의 기관과 유사하여 약물에 대한 반응을 더 잘 예측할 수 있음을 시사하고 있다. siRNA를 너머 miRNA mimics, Anti-mir, Block-mir, 혹은 saRNA와 같은 RNAi간섭에 대한 응용 연구도 활발히 진행 중에 있다. 이러한 기술들을 기반으로 향후 치료제는 치료할 수 있는 질병의 수와 범위를 크게 확대시킬 것으로 예상된다.
ONPATTRO의 승인으로 간으로의 RNAi 치료제의 전달은 이제 임상 현실로 다가왔다. 이는 간이나 신장 이외 다른 기관들에도 특이적으로 작용하는 치료제의 개발이 확장될 것이라는 긍정적인 영향을 주고 있다. RNAi 분야는 원하는 모든 유전자의 발현을 억제시킬 수 있으므로 antisense, ribozymes보다 무한한 가능성을 갖고 있다. siRNA 전달체의 개발로 많은 RNAi 치료제가 임상 실험으로 세상에 나오고 있는 현재, 아직 넘어야 할 장벽들이 많이 존재하지만, 장벽들을 뛰어넘는 전달 시스템을 구축하여 다양한 질병을 치료할 수 있는 RNAi 치료제가 되길 기대해본다.
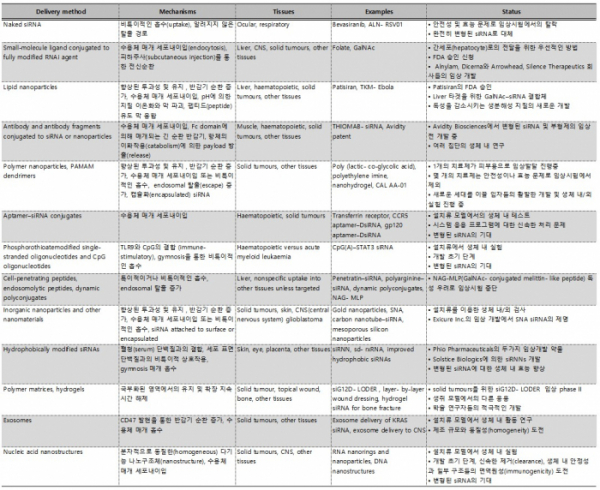
▲RNAi 치료제의 전달 방법과 부형제(excipient) 종류







