기사본문
[BioS 레터]발전하는 ASO, 글로벌 승인&개발 현황은?
입력 2021-01-12 10:25 수정 2021-01-12 10:25
이의정 객원연구원
안티센스 올리고뉴클레오타이드(Antisense oligonucleotides, ASO)는 RNAi치료제와 함께 개인 맞춤 의학을 실현시킬 수 있는 잠재적인 능력을 가진 약물이다. 평균 12~25개의 뉴클레오타이드로 합성된 단일 가닥 핵산 중합체는 타깃 RNA에 특이적으로 서열 상보성을 갖고 여러 메커니즘을 통해 단백질 발현을 조절한다.
◆ASO의 메커니즘
단일 가닥 ASO는 화학적 또는 결합 부위 및 타깃에 따라 유전자 발현을 조절하거나 여러 메커니즘을 통해 mRNA splicing에 영향을 줄 수 있다. ASO가 pre-mRNA 타깃 부위에 상보결합을 하면, RNA-DNA heteroduplex의 RNA 가닥을 가수 분해하는 Ribonuclease H(RNase H)가 활성화되어 타깃 mRNA 분해 및 단백질 발현을 억제한다(그림1-a). 현재 RNase H 타입의 gapmer ASO가 일반적이며, 핵과 세포질에서 모두 활성을 나타내는 장점을 갖는다.
또한, ASO는 ribosomal machinery의 steric block을 통해 alternative splicing에 의한 유전자 발현을 조절할 수 있다(그림1-b). splicing 신호를 숨겨 spliceosome의 인식을 방해하고 결국 스플라이싱 결과를 변화시키고, 이는 발현을 감소시키거나 스플라이싱의 조절 및 기능적 단백질을 재생산할 수 있게 한다. ASO는 단백질 번역(Translation)활동에도 영향을 줄 수 있는데, 번역되지 않은 인트론 같은 부위에 타깃하여 RNA 결합 단백질(60S와 40S)의 조립과 상호작용을 방해하거나 번역 활동을 활발히 시킬 수 있다(그림1-c, d).
이 외에도, ASO는 타깃 부위를 직접 억제하거나, ASO가 mRNA와의 결합으로 입체 장애를 이끌어내어 RNA 결합 단백질과의 상호작용을 방해하기도 한다. 다양한 메커니즘을 나타내는 ASO치료제 연구들이 진행되고 있으며, 이 중 RNaseH 활성과 splice modification을 이용한 많은 약물들이 FDA에서 승인이 되었거나 임상시험 중에 있다.
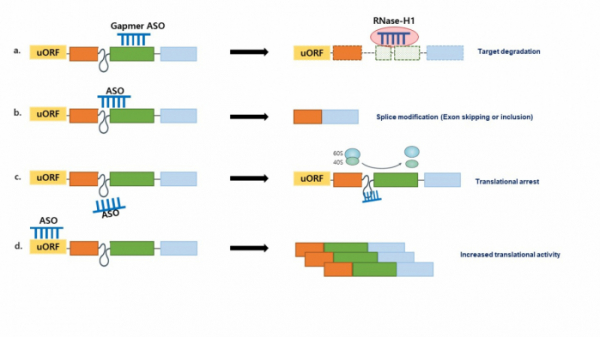
▲ASO의 메커니즘. a) ASO-mRNA heteroduplex는 RNase H1 효소를 불러와 표적 mRNA를 절단한다. b) ASO가 pre-mRNA의 splice 부위나 intron-exon signals에 상호작용하면, 표적 exon이 포함되거나 건너뛸 수 있다. c) 비번역 영역에 대한 높은 친화력을 갖는 ASO는 RNA 결합 단백질의 조립과 상호작용을 방지할 수 있다. d) uORF(upstream open reading frame)에 결합하는 ASO는 downstream ORF에서 번역되는 단백질의 양을 증가시킬 수 있다.
ASO는 처음 발견된 1978년도부터 1세대를 거쳐 현재 3세대까지 지속적으로 발전해왔다. 변형 전(구세대)의 ASO는 큰 크기와 전하로 인해 세포로의 확산이 어려웠고, 핵산 분해에 취약하다는 한계가 있었다. 하지만, 현재는 ASO의 화학적 변형들을 통해 면역반응과 off-target 독성 감소, 그리고 효소 안정성 및 약물 효율성이 증가되면서 단점을 보완해 ASO 치료제 상용화에 한걸음 다가설 수 있었다.
◆올리고뉴클레오타이드 변형
phosphorothioate (PS)
PS(phosphorothioate) 결합은 산소(oxygen) 원자 하나가 황(sulfur)으로 대체되어 핵산분해 효소에 대한 저항성을 나타내고, 알부민과 같은 혈장 단백질에 결합하는 것을 촉진하여 생체 내 순환을 더 오래 지속시키는 이점을 나타내었다. PS 입체 화학구조가 ASO의 약리학적 특성에 실질적으로 영향을 미친다는 것은 이미 증명되었는데, 이는 gapmer ASO의 ‘gap’ 영역이 포함된 3’-SpSpRp-5’ 입체화학적 코드는 RNASE H1에 의한 RNA 분해를 촉진시키는 것으로 나타났다.
PMO와 PNA
PMO(Phosphorodiamidate morpolino oligonucleotide)는 5각형의 리보스 heterocycle이 6각형의 morpholine 고리(ring)로 대체되는 핵산 화학작용이다. PMO는 중성 전하를 나타내며 steric block이나 splice 변형에 의한 ASO 효과를 나타낸다. PNA(Peptide nucleic acid)는 methyl carbonyl 연결에 의해 DNA 염기(A, T, G, C)와 중성 N-2-aminoethyl glycine 유닛을 가진 핵산 모방체이다. PNA는 효소 분해에 저항성이 있고, 강하게 타깃 RNA에 결합할 수 있다. 하지만, 낮은 용해도와 세포 흡수에 대한 장벽이 있어, PNA의 변형이나 양이온성 PNA, alpha and gamma guanidium PNAs와 lysine PNAs 등의 해결책을 연구중에 있다.
Locked nucleic acid (LNA)
LNA(Locked nucleic acids)는 리보스 당에서 2번 산소와 4번 탄소 사이에 methylene bridge를 가지고 있으며 타깃 DNA나 RNA에 강한 결합력을 갖는다. 갭머(Gapmer)는 LNA-DNA-LNA 기반으로 설계된 것으로, 이는 RNase H1 기반 절단 메커니즘을 자극한다.
Ribose Modifications
리보스 당(ribose sugar)의 2’ 위치에서 2ʹ-O-methyl (2ʹ-OMe), 2ʹ-O-methoxyethyl (2ʹ-MOE)과 2ʹ-Fluoro (2ʹ-F)로의 변형은 결합력을 높이고 핵산 분해효소 저항성을 높여준다. 이러한 변형은 혈장에서의 안정성을 향상시키고 조직(Tissue) 반감기를 증가시키며 결과적으로 약물효과를 연장시킨다. 더하여, 핵산 염기 변형(Nucleobase modification)중에서는 cytosine analogs는 면역자극을 최소화하고 효율성을 증가시키기 위해 광범위하게 사용되어 왔다.
한편, 현재 수많은 ASO 후보물질이 심혈관, 신경질환, 대사질환 등의 다양한 질병들을 치료하기 위해 임상시험을 진행중이다. 최근 미국 식품의약국(FDA)이 여러 핵산 기반 약물에 대한 시판을 승인하면서 ASO 연구에 대한 관심이 더욱 높아지고 있다. FDA가 승인한 ASO 치료제와 현재 임상시험에서 ASO기반 약물 후보에 대해 간략하게 살펴봤다.
◆FDA에서 승인받은 ASO 치료제
Vitravene™(Fomivirsen)
1998년, 비트라벤(Vitravene™, Fomivirsen)은 아이오니스 파마슈티컬스(Ionis Pharmaceuticals)에 의해 개발된 최초의 ASO 기반 약물이었다. 비트라벤은 면역 손상 에이즈 환자에서 사이토메갈로바이러스(cytomegalovirus, CMV) 감염으로 인한 망막염의 치료제로 FDA의 승인을 받았다. 비트라벤은 PS(phosphorothioate) 기반의 21mer ASO 치료제로, CMV mRNA의 코딩 서열에 타깃해 바이러스의 복제를 억제시켜 에이즈 환자들에게서 CMV 감염에 의해 시력을 잃지 않게 도와주었다. 비트라벤은 무작위 임상시험에서 효능을 입증했으나, 항레트로바이러스 치료의 성공으로 인해 자발적으로 시장에서 철수했다.
Kynamro, Mipomersen)
동질접합체적 가족성 고콜레스테롤 혈증(Homozygous familial hypercholesterolemia, HoFH)은 상염색체 우성 유전 질환으로 저밀도 지단백질(LDL) 수치가 높아지는 질병이다. HoFH는 LDL 콜레스테롤 수용체(LDLR)나 Proprotein convertase subtilisin/kexin type 9(PCSK9), 또는 Apolipoprotein B(Apo B)의 유전자 돌연변이에 의해 발생한다. 젠자임(Genzyme)이 개발한 ‘카이남로(Kynamro, Mipomersen)’는 2′-MOE and PS modified ASO gapmer 치료제로 Apo B-100 mRNA를 타깃하여 Apo B-100의 합성을 억제한다. 이에 따라 atherogenic lipoproteins VLDL, IDL, LDL, and lipoprotein(a) 생산이 감소되는 것을 확인하였다.
Spinraza®(Nusinersen)
척수성 근위축증(Spinal muscular atrophy, SMA)은 5q13 염색체에 있는 survival motor neuron 1(SMN1)에서 동형접합 결손에 의해 야기되는 유전질환이다. 일반적으로 SMN 계열은 SMN1과 SMN2의 두 유전자를 포함하고 있기에, SMN1이 결손되면 SMN2를 alternative splicing사용하는 방법으로 질병을 치료할 수 있다. 스핀라자는 소아 및 성인 환자에서 SMA 치료를 위해 바이오젠(Biogen)이 개발한 ASO 기반 약물로, 2-O-MOE와 PS-based 변형을 포함하고 있다. 스핀라자는 SMN2 pre-mRNA와 결합하여 splicing repressor활성을 억제하고, SMN2 mRNA에 exon 7을 가진 정상적인 기능을 하는 SMN을 생성하게 한다.
Tegsedi®(Inotersen)
테그세디는 2018년 아이오니스에서 티렌스티레틴 아밀로이드증(hereditary transthyretin-mediated amyloidosis (hATTR) 치료를 위해 개발되었다. 이노테르센은 gapmer design으로 구성되어 있는 2ʹ-MOE-modified PS 변형으로, transthyretin(TTR) mRNA와의 ASO 결합을 증가시켰다. 최근 hATTR 치료제로 앨라일람(Alnylam)에서 개발한 ‘온파트로(Onpattro®, Patisiran)는 첫번째 siRNA-based 약물로 미국 FDA와 유럽의약품청(EMA)에서 승인받았다.
Exondys 51®(Eteplirsen)
뒤센 근이영양증(Duchenne muscular dystrophy, DMD)은 디스트로핀을 암호화하는 DMD 유전자의 돌연변이로 인한 치명적인 근육 퇴행성 질환이다. 이 부분 유전자의 결손은 기능적 디스트로핀 단백질 생성을 방해할 뿐 아니라 mRNA 파괴를 유도한다. 엑손디스51은 사렙타(Sarepta Therapeutics)가 DMD 치료를 위해 개발한 PMO-based 화학 변형을 포함하는 30 mer ASO 치료제다. 이 약물은 DMD 유전자의 엑손 51에 결합하여 디스트로핀 mRNA의 reading frame을 복원하여 짧지만 기능을 하는 디스트로핀 단백질을 생성한다. DMD의 첫번째 치료제이고, 병의 심각성에 따라 가속승인 절차에 따라 2016년 FDA에서 승인됐다. FDA는 사렙타에 엑손디스51의 임상적 효능을 확인할 수 있는 추가적인 임상을 요구했으며, 추가 임상에서 효능을 입증하지 못할 경우 승인이 취소된다.
Milasen
밀라센(Milasen)은 신경세포 세로이드 라이포푸신증 7(neuronal ceroid lipofuscinosis 7, CLN7)을 앓고 있는 6세 어린이를 치료하기 위해 고안된 개인화 ASO 치료제이다. 이 환자의 전체 게놈 시퀀싱(WGS)을 통해 MFSD8(CLN7) 유전자에 SINE-VNTR-Alu(SVA) 레트로트랜스포존(retro-transposon)이 삽입돼 전사물의 스플라이싱이 변화되는 것을 확인했다. 밀라센은 22-뉴클레오타이드 길이를 가지고 splice 부위를 표적으로 하여 정상 exon 6-7 스플라이싱 능력을 회복시켰다. 밀라센은 예비 임상 전 긍정적인 결과에 근거하여 이 환자에게 사용을 위한 신속한 N-of-1(In single patient) 승인을 받았다. 밀라센은 환자의 삶의 질을 효과적으로 향상시킴으로써, N-of-1 환자에서 CLN7 병을 목표로 한 밀라센의 개발은 RNA 기반 개인화된 의학 치료에 대한 기대를 더욱 높여주었다.
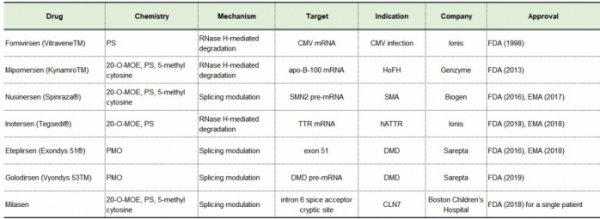
▲표1. FDA 승인 ASO 치료제들
◆임상 개발 중인 ASO 약물들
Tominersen
토미너센(Tominersen, RG6042)은 아이오니스가 개발한 헌팅턴병(mHTT)에 대한 ASO 치료제다. 헌팅턴병(Huntington disease, HD)은 상염색체 우성 유전 및 진행성 신경퇴행성 질환으로, 유전체 4p 16.3에 위치한 유전자 HD에서 CAG 염기가 반복되어 증가되면서 폴리글루타민(polyglutamine)을 가진 돌연변이 헌팅턴(mHTT) 단백질이 생성되면서 발병한다. 이 mHTT는 뉴런에 축적되어 정상적인 기능을 방해하기에 Tominersen는 mHTT mRNA를 타깃하여 단백질 생성을 억제한다. Tominersen는 초기 HD 환자 46명 대상으로 임상 1기와 2기에서 긍정적인 결과를 얻어냈다.
Tofersen
토퍼센(Tofersen)은 돌연변이 SOD1 mRNA를 타깃해 가족성 근위축증(familial amyotrophic lateral sclerosis, ALS) 진행을 억제하는 ASO 치료제로 개발되었다. SOD1(Superoxide dismutase1) 유전자의 돌연변이는 비정상적인 기능을 하는 SOD1을 생산하고 세포에 독성 단백질로 축적되어 가족성 근위축성 측색 경화증(ALS)을 야기시킨다. 바이오젠에서 개발한 토퍼센은 임상 1상과 2상에서 기능장애 뇌척수액 SOD1 농도의 감소를 보여주었으며, SOD1-ALS 환자에서 현재 3상 임상시험이 진행 중에 있다.
Waylivra®(Volanesorsen)
아이오니스가 개발한 웨이리브라(Waylivra)는 간에서의 APOC3 mRNA를 억제하여 혈장 중성지방과 apolipoprotein C-III 수치를 감소시켜 가족성 킬로미크론혈증 증후군(Familial chylomicronemia syndrome, FCS)를 치료하는 목적을 갖는다. 웨이리브라를 투여한 66명의 환자에서 3개월 후의 기준선에서 apolipoprotein C-III 수치는 84.2% 감소하였지만, 실험기간 동안 몇몇 환자에게서 혈소판 수 감소 및 경미한 주사부위 반응이 관찰됐다. 이에 따라, 미국 식품의약국(FDA)은 혈소판감소증의 안전성과 출혈 위험을 근거로 해당 약물 승인을 거절하였다. 하지만, 유럽에서는 유전성 FCS 환자 및 지질저하 치료가 효과적이지 않은 급성 췌장염 위험군 환자 치료를 위한 조건부허가를 주었으며, 추가로 아이오니스에 환자들의 안전과 효능에 대한 추가 자료를 요청했다.
Alicaforsen
앨리카포센(Alicaforsen)은 Atlantic Healthcare에서 개발한 주머니염(Pouchitis)에 대한 ASO 치료제이다. 주머니염(Pouchitis)은 수술이나 궤양성 대장염의 합병증으로 인해 발생하는 염증이다. 세포간 접착 분자-1(Intercellular adhesion molecule-1, ICAM-1)은 백혈구를 염증 부위로 불러들이는 세포 표면 수용체로, 파우치염에서 염증 반응을 증가시킨다. 이에 따라 앨리카포센은 ICAM-1 mRNA를 타깃해 염증 반응을 감소시킨다.
Vutrisiran
부트리시란(Vutrisiran)은 앨라일람(Alnylam)이 hATTR 치료를 위해 개발한 약물이다. 이 약의 작용 메커니즘은 온파트로와 같다. 부트리시란은 현재 임상 3상이 진행 중이다.

▲표2. 임상 시험 진행 중인 치료제 후보군들
아이오니스와 앨라일람은 글로벌 RNA 치료제 업체의 선두주자로 많은 RNA 치료제에 대한 연구와 임상 시험이 진행되고 있다. 국내에서도 올릭스, 올리패스, 바이오니아, 바이오오케스트라 등이 RNA 치료제 개발에 힘을 쏟고 있다. 최근에는 시선테라퓨틱스가 PNA 자체를 나노 입자화해 세포 안으로 전달시켜 약물 효능을 극대화하는 POLIGO 기술에 대해 미국 특허를 획득했다.
RNA 치료제 시장은 현재 시장성장 초기 단계로 보이지만, 활발한 FDA 승인 및 임상시험이 이루어지고 있어 높은 성장세를 보일 것으로 기대된다. 또, 다양한 질병 및 여러 조직에 특이적인 타깃 ASO 개발을 위해, systematic RNase H mapping, 다양한 경우의 수를 가진 mRNA 상보 서열, combinatorial arrays의 사용, computational methods에 의한 2차 구조 예측, 예측 통계 모델링에 기초한 in-silico 사전 스크리닝 등의 여러 방법으로 다양하고 효율적인 ASO 설계가 진행되고 있다.
Reference
- Karishma Dhuri et al, Antisense Oligonucleotides: An Emerging Area in Drug Discovery and Development, J. Clin. Med. 2020, 9(6)
- Daniel R. Scoles et al, Antisense oligonucleotides, Neurol Genet 2019;5:e323. doi:10.1212/NXG.0000000000000323
- Carlo Rinaldi and Matthew J. A. Wood, Antisense oligonucleotides: the next frontier for treatment of neurological disorders, Nature Reviews Neurology volume 14, 9–21(2018) doi:10.1038/nrneurol.2017.148
- Anaïs M. Quemener et al, The powerful world of antisense oligonucleotides: From bench to bedside, Wiley Interdiscip Rev RNA, 2020 Sep;11(5):e1594. doi: 10.1002/wrna.1594







