기사본문
오릭, 보로노이 'exon20 저해제' 공개.."BBB투과 강점"
입력 2021-04-19 11:05 수정 2021-04-19 11:13
바이오스펙테이터 김성민 기자
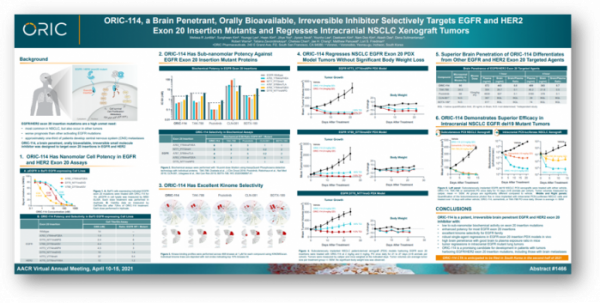
▲오릭의 ORIC-114 AACR 2021 포스터 발표자료
미국 오릭 파마슈티컬(ORIC Pharmaceuticals)이 지난해 국내 바이오텍 보로노이(Voronoi)로부터 중화권을 제외한 글로벌 개발 및 상업화 권리를 라이선스인(L/I)한 EGFR·HER2 엑손20 삽입변이(exon20 insertion mutation) 저해제 ‘ORIC-114’의 비임상 데이터를 공개했다. 오릭은 당시 ORIC-114가 경쟁약물 대비 우수한 혈뇌장벽(BBB) 투과성을 가진다는 점을 강조했다.
또한 보로노이도 이번 AACR에서 비슷한 전략으로 자체 개발하고 있는, 뇌 투과율을 높인 HER2 저해제 'VRN10'의 경쟁 경구용 HER2 저해제 대비 차별성을 보여주는 데이터를 발표했다.
오릭은 지난 9일부터 14일(현지시간)까지 열린 미국 암 연구학회(AACR) 2021에서 경쟁 물질 대비 ORIC-114가 가지는 차별성을 보여주는 데이터를 발표했다. 오릭은 올해 하반기 한국내 임상을 위한 임상시험계획서(CTA)를 제출할 예정이라고 밝혔다. 그밖에도 오릭은 이번 학회에서 글루코코티코이드 수용체(GR) 길항제 ‘ORIC-101’, 경구용 CD73 저해제 ‘ORIC-533’, PRC2 저해제 ‘ORIC-944’ 등을 발표했다.
아직까지 EGFR·HER2 엑손20 삽입변이를 타깃한 치료제는 없지만, 올해를 기점으로 잇따른 약물 시판이 예고되고 있다. 경쟁 약물로 얀센 파마슈티컬(Jassen Pharmaceuticals)이 EGFR 엑손20 삽입변이를 가진 비소세포폐암(NSCLC) 환자에게 ‘아미반타맙(amivantamab)’을 투여해 전체 반응률(ORR) 40%라는 긍정적인 결과를 얻었다. 얀센은 지난해 12월 미국 식품의약국(FDA)에 해당 적응증에 대한 바이오의약품 품목허가 신청서(BLA)를 신청한 바 있다. 첫 EGFR 엑손20 삽입변이 치료제가 기대된다.... <계속>







