기사본문
알비레오, 'IBAT 저해제' FDA 승인.."PFIC 첫 치료제"
입력 2021-07-27 09:34 수정 2021-07-27 14:40
바이오스펙테이터 윤소영 기자
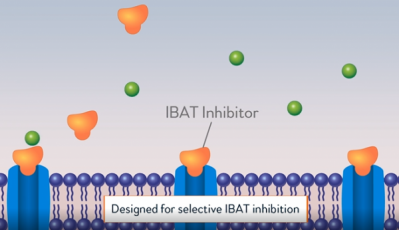
알비레오(Albireo pharma)가 희귀 간질환인 ‘진행성 가족성 간내 담즙정체증(Progressive Familial Intrahepatic Cholestasis, PFIC)’에 대한 경구용 치료제 ‘바일베이(Bylvay, odevixibat)’의 미국 식품의약국 시판허가 승인을 받았다. 이번 승인으로 현재까지 치료 옵션이 외과적 수술로 제한적이었던 PFIC의 치료에 새로운 옵션이 생겼다.
알비레오(Albireo pharma)는 지난 20일(현지시간) IBAT(Ileal Bile Acid Transport) 저해제 바일베이가 미국 식품의약국(FDA)에 의해 진행성 가족성 간내 담즙정체증(PFIC) 치료제로 승인됐다고 발표했다.
론 쿠퍼(Ron Cooper) 알비레오 대표는 “바일베이는 소아 담즙정체성 간질환 치료제로 첫 FDA 승인을 받은 약물”이라며 “비외과적 치료법으로 PFIC 환자들의 부담을 줄였다”고 말했다.
PFIC은 유전자변이에 의한 담즙산 분비이상으로 발생하는 질환으로, 간 및 혈액의 담즙산 농도가 높아지며 발병한다. 담즙산의 축적은 간에 손상을 주며 주요 증상으로는 가려움(pruritus)이 있다. 증상은 생후 3개월부터 발생하며 치료가 되지 않을 경우 대부분 10세 이전에 간부전(liver failure)이 발생하고, 30세까지 생존이 어려워 그 전에 간이식을 받아야 한다고 알려져 있다.... <계속>







