기사본문
BBB(혈관-뇌 장벽) 넘는 블록버스터 신약 나올까?
입력 2016-09-23 09:02 수정 2016-09-23 09:09
바이오스펙테이터 조정민 기자
뇌는 자신만의 방어 체제를 가진 유일한 기관이다. 우리 몸의 혈관과 세포 사이에서는 다양한 물질 교환이 이루어지는데 뇌의 경우, 접착인자 단백질로 인해 혈관 내피세포 사이의 간격이 더 좁게 연접돼(Tight junction) 큰 분자량의 물질 등이 통과하기 어렵다. 또한 모세혈관의 겉을 아교세포(Glia cell)가 감싸 안는 형태로 둘러싸고 있다. 이처럼 혈액을 통해 뇌로 가는 물질을 걸러주는 거름망 역할을 하는 장벽을 혈관-뇌 장벽 Blood-Brain Barrier(BBB)라고 한다.
뇌는 이처럼 BBB를 통해 선별된 필요 영양소만 받아들이고 외부 물질들을 효과적으로 차단한다. 대부분 매우 작은 크기의 물질이나 지용성 물질, 호르몬들은 BBB의 혈관 내피세포 (endothelial cell)를 직접 통과하고 당이나 인슐린과 같은 큰 분자의 물질과 수용성 물질들은 세포막 표면에 존재하는 막단백질을 통해 내부로 운반된다.
◇치료제도 통과하기 힘든 BBB
정상적인 상황의 경우, BBB는 외부 물질의 침입을 막아주는 1차 방어벽으로 기능하며 우리 몸의 건강을 유지하는데 도움을 주겠지만 병리적 상황에서는 치료에 어려움을 주는 장애물로 작용한다.
뇌질환의 치료 목적이나 상태 유지를 위한 목적의 치료제들 역시 이에 가로막히고 만다. 95%의 약물이 BBB를 통과하는 퍼센티지가 매우 낮고 뇌에서 효과적인 작용을 하지 못한다. 이 때문에 다양한 뇌 질환 환자들이 약물 치료에서 가질 수 있는 선택권이 제한적이다.
뇌 질환의 치료를 위한 사용할 수 있는 방법들 중 한 가지는 지용성의 약물을 만드는 것이다. 지용성 물질은 인지질 2중막 구조의 세포막을 통과하는데 용이하기 때문이다. 하지만 이는 뇌 뿐 아니라 다른 장기에서도 적용되기 때문에 표적 기관이 아닌 곳에서의 부작용도 만만치 않다. 또한 지용성 물질이 내피세포의 세포막 통과에 이점이 있지만 막 내 유출 펌프에 의해 빠르게 배출되는 단점도 있다.
또 다른 방법은 선천적 영양소 전달 체계 (Natural nutrient transport system)를 이용하는 것이다. 대표적인 예로 파킨슨 병의 증상 완화를 위해 사용되는 L-dopa가 있다. 도파민이 BBB를 통과하지 못하므로 크기가 작은 도파민 전구물질을 넣어 전달 체계를 통해 활성화 되도록 하는 방법이다. 하지만 이는 환자 별로 전달의 효율성이 각각 다르므로 부작용이 없는 적정 농도의 용량을 정하기 힘든 단점이 존재한다.
◇BBB 너머를 위한 다양한 시도
이처럼 BBB로 인해서 많은 뇌 질환 환자들의 치료에 어려움을 겪고 있어, 많은 연구진들은 BBB를 통과하여 효과적으로 약물을 처치하기 위한 다양한 방법을 연구 중에 있다.
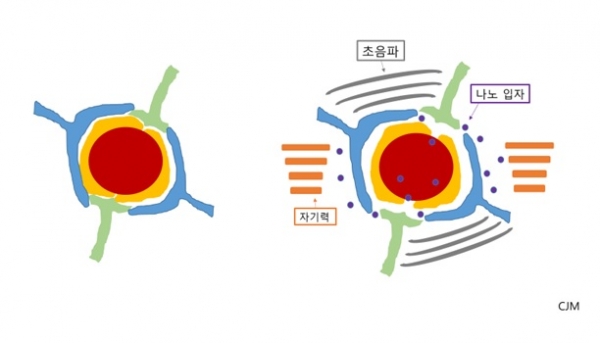
그 중 하나는 초음파를 이용해 BBB의 물리적 공간을 넓힌 다음, 이완된 공간에 화학 요법 약물로 코팅한 자성을 가진 나노 입자를 주입하는 방법이다. 타이완 연구진은 동물 실험 단계에서 이 기술의 효율성을 확인했고 캐나다에서 일부 뇌종양 환자들에게 시범적으로 적용해 종양의 성장을 저해하는 효과를 볼 수 있었다.
혈관에 고 삼투압 용액을 주입해 내피세포가 일시적으로 수축하게 한 뒤, 그 사이로 약물을 주입하는 방법 역시 연구되고 있는 것 중 하나이다.
체내 생성 펩타이드(2~50개의 아미노산의 펩타이드 결합으로 이루어진 산물) 혹은 내피 세포 막에 존재하는 수용체(receptor) 에 결합하는 단클론성항체 (monoclonal antibody)를 부착해 통과시키는 일명 ‘트로이목마 (Trojan horse)’ 기법이 동물 실험에서 성공적으로 수행됐지만 아직 임상 적용에는 많은 주의를 요한다.
◇BBB 넘는 블록버스터 신약 나오나
아직까지 BBB를 통과하는 것으로 알려진 약물은 많지 않다.
미국의 바이오젠과 스위스 취리히 대학교 공동 연구진이 개발한 알츠하이머 항체 치료제 ‘아두카누맙’이 임상 3상을 진행하고 있다. 이 약물은 알츠하이머의 원인으로 알려진 뇌의 베타 아밀로이드의 항원 특이적 입체분자구조에 결합하여 파괴하고 인지능력 감퇴를 저지시키는 효과를 보였다.
아스트로제네카에서 나온 EGFR (상피세포 성장인자 수용체) 변이 양성 비소세포폐암 치료제 ‘타그리소’는 비소세포폐암 환자들 중 뇌로 전이가 일어난 대상자에게 투여했을 때 뇌척수액에서 EGFR의 변이를 저해하는 것으로 나타났다. 이는 ‘타그리소’가 BBB를 통과하여 중추신경계에 작용한다는 의미를 내포한다.
국내에서도 활발한 연구가 진행 중이다. 에이비엘바이오(ABLbio)는 하나의 항체가 두 개의 항원을 인지할 수 있는 이중 항체 기술을 바탕으로 뇌 질환 치료제를 개발하고 있다. 철을 수송하는 혈중단백질인 트랜스페린(transferrin)에 항원-항체를 결합해 BBB를 통과하고 타겟 물질에 또 다시 결합해 작용하는 이중항체를 동물실험을 진행했다. 에이비엘바이오는 BBB에서 발현하는 여러 후보 물질을 확보하고 다양한 질환에 적용할 수 있도록 확장할 계획이다.
일동제약은 거대분자 세포 내 전송기술 (MITT)를 이용한 파킨슨 병 치료제 개발에 착수했다. 바이오벤처 셀리버리의 원천 기술인 MITT는 거대 분자를 세포 내로 이동시키는 거대분자 전송 도메인(MTD, Macromolecule Transduction Domain)에 치료 약물이나 펩타이드, 항체 등을 연결해 세포 안으로 전달하는 방법이다. 이들은 파킨스 병 모델 동물에 MITT기법으로 알파-시누클레인의 형성, 축적으로 사멸하는 신경세포에 신경보호물질을 주입하는 실험을 한 결과, 쥐의 상실한 운동성을 80%이상 회복시키는 등의 효과를 보인다고 발표했다.