기사본문
[남궁석의 신약연구史]코로나19 '백신' 언제 나올까?
입력 2020-04-08 09:34 수정 2020-04-08 09:34
남궁석 SLMS(Secret Lab of Mad Scientist) 대표
코로나바이러스 질환의 치료제 개발 노력
2003년의 사스의 경우 미처 치료제나 백신이 개발되기도 전인 발견 8개월 만에 종적을 감추었고, 메르스의 경우에는 전세계적인 유행이 되지는 않은 국소적인 유행으로 그친 상황이었다. 따라서 코로나바이러스에 유효한 치료제나 백신을 개발할 충분한 동기 부여가 되지 않는 상황에서 2019년 코로나-19의 범유행에 직면한 인류는 여기에 대응할 유효한 치료수단을 가지고 있지 못한 상태였다. 그렇다고 당장 벌어지는 범유행에 손 놓고 있을 수도 없는 일이다.
결국 코로나-19의 치료를 위해서 기존에 다른 바이러스 질병을 대상으로 개발되어 이미 허가가 난 항바이러스 제제 등을 코로나-19 환자들의 치료에 이용하는 약물 리포지셔닝(Drug repositioning)이 시도될 수 밖에 없었다. 제일 먼저 시도된 것들은 기존의 다른 바이러스 대상으로 개발된 항바이러스제제들이었다.
처음에 시도된 계열의 약물은 HIV/AIDS를 효과적으로 치료한 HAART의 핵심 구성요소였던 단백질 분해효소 저해제였다. HIV와 유사하게, 코로나바이러스의 구성 단백질 중 16개의 비 구조 단백질은 일단 두 개의 큰 단백질로 만들어진 다음 단백질 분해효소에 의해서 분해되어 형성된다. 따라서 HIV 치료제로 개발되었던 기존의 단백질 분해효소 저해제인 로피나비르(Lopinavir)나 티토나비르(Ritonavir)가 SARS-CoV-2에 대한 항바이러스 활성을 가지는지 임상시험이 바로 시작되었다. 그러나 약 199명의 중증 코로나-19 환자를 대상으로 수행된 임상시험 결과, 이 두가지 단백질 분해효소 저해제의 병용은 표준적인 치료에 비해서 장점이 없다는 것이 판명되었다[28]. 바이러스의 단백질 분해효소가 서로 다른 서열 인식 특이성을 가지고 있다는 것을 생각한다면, HIV 단백질 분해효소 저해제가 코로나바이러스의 단백질 분해효소에 큰 효과가 없는 것은 크게 놀라운 일은 아닐 것이다.
그 다음으로 시도된 것은 코로나바이러스의 RNA 지놈을 복제하는 RNA 중합효소(RdRp)의 저해제였다. HIV나 HCV의 치료제 개발 과정에서도 보았듯이 RNA 중합효소나 역전사효소를 억제하는 저해제들은 RNA 중합효소에 결합하여 이의 활성을 저해하여 바이러스의 복제를 직접적으로 막을 수 있을 것으로 기대되었다. 따라서 이전에 다른 바이러스 대상으로 개발된 다양한 RNA 중합효소 저해제가 코로나-19 환자에 투여되기 시작하였다.
코로나-19가 제일 먼저 창궐한 중국에서 제일 먼저 시험되기 시작한 RNA 중합효소 저해제는 일본의 후지필름에서 개발한 광범위 항바이러스 활성 물질인 파비피라비르(Favipiravir, 상품명 아비간 Avigan)이었다. 핵산과 어느정도 구조가 유사한 피라진카복사미드(pyrazinecarboxamide)계열의 물질인 파비피라비르는 세포 내에서 파비피라비르-리보푸라노실-5-삼인산으로 변화되어 RNA 중합효소를 억제한다. 원래 인플루엔자 치료제로 기대되었으나 인플루엔자에서는 별 효과를 보이지 못했고, 에볼라 바이러스의 치료의 경우 높은 수준의 바이러스에서는 큰 효과가 없었으나 바이러스 수준이 낮은 경우에는 어느 정도의 치료 효과를 보였다. 중국에서 코로나-19 환자를 대상으로 시험되었고 그 효과의 평가는 현재 진행중이다.
다른 RNA 중합효소 저해제로 테스트되고 있는 것은 길리어드의 렘데시비르(Remdesivir)이다. 렘데시비르는 HCV를 완치시킨 것으로 유명한 소포스루비르(상품명:소발디)와 마찬가지로 프로타이드(ProTide) 전략에 의해서 디자인된 약물이다. 즉 기존의 핵산 유도체의 경우 인산화되는 과정에 오래 걸리는 반면 렘데시비르는 아데노신 일인산 유사체의 인산기에 별도의 블로킹 그룹이 결합되어 있어 인산기의 음성 전하를 중화시켜 세포 내로의 흡수를 도와주고, 세포 내에서 흡수된 후 블로킹 그룹이 분해되어 활성을 가지는 형태로 전환되도록 만들어진 약물이다. 이 약물은 원래 에볼라 바이러스의 치료제로 기대를 모았으나, 기대와는 달리 에볼라 바이러스의 치료에는 별다른 효과를 보이지 못했다. 반면 세포 수준이나 원숭이 등의 실험동물을 이용한 전임상 실험에서는 효과적으로 코로나바이러스에 대한 항바이러스 활성을 보임으로써, 코로나바이러스 치료제로 기대되기 시작되었다. 길리어드는 2020년 3월부터 미국, 일본, 중국에서 중증 코로나-19 환자를 대상으로 이의 임상시험을 시작하였고 그 결과는 2020년 4월에 발표될 예정이다.
SARS-CoV-2에 대한 항바이러스 효과가 기대되고 있는 약물 중 하나는 이전에 항말라리아 약물로 사용되고 있던 클로로퀸(Chloroquine) 및 히드록시클로로퀸(Hydroxychloroquine)이다. 이들 약물은 항말라리아의 효과 이외에도 루프스(Lupus) 등의 자기면역질환의 증상을 덜어주는 효능이 이전부터 알려져 있었다. 그 이후 1980년대의 HIV 범유행 시절에 이 물질이 다양한 바이러스의 증식을 억제하는 효과가 있다는 것이 알려지기 시작하였고, SARS-CoV의 번식을 세포 내에서 억제한다는 것 역시 밝혀졌다. 2019년 코로나-19의 세계적 범유행 이후에 히드록시클로로퀸이 SARS-CoV-2의 증식을 체외 배양세포 내에서 억제한다는 것이 알려진 이후, 이를 코로나-19 환자 치료에 도입하기 시작하였으나, 그 효과가 검증되는데는 시간이 필요하다.
그렇다면 1930년대에 발견된 오래된 항 말라리아 약물이 어떻게 SARS-CoV-2를 억제하는 약물로 떠오르게 되었는가? 사실 아직 정확한 작용 기전은 확실히 알려지지 않았지만 여기에는 두 가지 가능성이 있다. 그중 하나는 히드록시클로로퀸이 세포 내의 라이소솜(Lysosome) 내부의 pH를 높이는 성질을 가지고 있기 때문이다. 세포 내의 라이소솜은 약 pH 4.6에서 최적으로 작동하고, 많은 바이러스들이 세포 내에 침투하는 과정은 엔도솜-라이소솜을 경유하며, 여기서 pH가 어느정도만 변해도 바이러스의 증식을 크게 저하한다. 또 다른 가능성은 클로로퀸/히드록시클로로퀸이 자가면역질환의 증상을 경감해주는 치료제로 사용하는 것과도 관련이 있다. SARS/코로나-19 중증 환자들은 종종 지나친 선천성 면역반응의 유발로 사이토카인 수준이 급격히 높아지는 ‘사이토카인 폭풍’(Cytokine storm)에 의한 문제를 겪고 있다. 아직도 정확한 기전은 밝혀지지 않았지만 클로로퀸/히드록시퀸은 선천성 면역반응을 억제해주는 능력 때문에 루프스(Lupus)나 류마티스성 관절염 치료약으로도 사용되고 있는데, 이러한 능력이 중증 코로나-19 환자들의 치료에 유용하게 사용될 수 있을 것으로 기대되고 있다.
그리고 바이러스 자체를 억제하는 것 이외에 중증 환자의 증세를 경감시키기 위한 대증요법(symptomatic therapy)로 여러가지 가능성이 검토되고 있다. 증세가 심각한 환자들에서 나타났던 현상 중의 하나는 염증반응을 일으키는 사이토카인 중의 하나인 인터루킨-6(IL-6)의 수준이 혈중 바이러스 수준과 사망자에게서 현격하게 높다는 것이었다[29]. IL-6 의 기능을 억제함으로써 중증 코로나-19 환자에게서 일어나는 사이토카인 폭풍을 억제함으로써 중증 환자를 치료할 수 있다는 가능성이 제시되기 시작되었다. 이미 자가면역질환인 류마티스성 관절염의 치료 목적으로 IL-6이 수용체에 결합하는 것을 억제하기 위하여 IL-6 수용체에 결합하는 항체인 토실리주맙(Tocilizumab)이 개발되었고, 2010년부터 ‘악템라’(ACTEMRA)라는 이름으로 시판되어 류마티스성 관절염의 치료에 사용되고 있다. 2020년 3월 토실리주맙의 개발사인 제넨테크는 코로나-19 환자 대상으로 토실리주맙의 3상 시험을 개시하였다. IL-6을 억제하는 바이오로직이 중증 코로나-19 환자의 증상을 경감시키는데 어느 정도 효과가 있을지는 이러한 임상 시험이 끝난 이후에야 확실히 이야기할 수 있을 것이다.
또 다른 전략으로는 SARS-CoV-2가 수용체로 사용하는 ACE2 단백질을 재조합 단백질로 환자에게 투여하는 것이다. 바이러스가 세포 내에 침투하는 수용체로 사용하는 ACE2를 바이러스 감염자에 단백질로 주사한다는 것이 얼핏 생각하면 잘 이해가 안될지도 모른다. 그러나 바이러스가 수용체로 사용하는 ACE2는 세포막에 결합되어 있는 막 단백질이지만 주사하는 재조합 단백질은 생체막에 결합하는 부분이 없는 수용성 형태이므로 바이러스의 침투에는 사용될 수 없다. 주사된 ACE2는 SARS-CoV-2와 결합하여 생체막에 존재하는 ACE2의 결합을 경쟁적으로 저해하여 바이러스의 세포내 침투를 막는다. 또한 ACE2는 바이러스가 바이러스의 수용체로 사용되면서 덩달아 억제된 ACE2의 기능을 복원하는 역할을 한다. SARS-CoV/SARS-CoV-2에 감염된 세포에서는 수용체인 ACE2의 발현이 억제되는데, 이에 따라서 원래 ACE2가 수행하는 안지오텐신-II의 변환 과정이 억제되고 따라서 과다한 안지오텐신-II이 폐에서 축적된다. 과다한 안지오텐신-II는 폐 손상을 유발하는 원인이 되며, 이때 외부에서 공급된 ACE2는 축적된 안지오텐신-II를 제거해 주어 이러한 문제를 해결해 줄 수 있다는 주장이다.
심지어는 발기부전 치료제인 실데나필(Sildenafil)까지 코로나-19의 대증요법에 동원되고 있다. 과연 어떤 효과 때문일까? 실데나필은 원래 혈관 확장 작용으로 협십증을 치료하려는 목적으로 개발되었고 그 특성이 발기부전 치료에 잘 활용되었다. 실데나필은 폐동맥 역시 확장효과를 보이고 이는 코로나-19 에 의한 호흡 부전에 도움을 줄 수 있을 것이라는 논리이다.
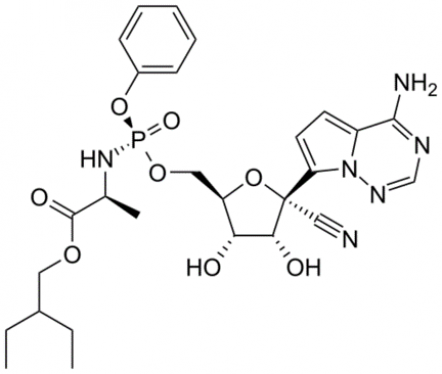
▲그림 3. 코로나-19 치료제로 많은 기대를 받고 있는 길리어드의 렘데시비르 (Remdesivir). 렘데시비르는 길리어드의 C형 간염 치료제인 소포르비루(상품명 소발디) 와 마찬가지로 ‘프로타이드’ (Protide)라는 전략으로 만들어졌다. 핵산 유사체의 인산기에 블로킹 그룹을 결합시켜 인산기의 음성 전하를 중화시켜 세포내로의 흡수를 높이고, 세포에 들어가서 블로킹 그룹이 분해되어 아데노신 일인산의 유사체로 작동하여 바이러스의 RNA 중합효소를 억제하는 것이 그 작동 기전이다.
코로나바이러스 백신의 개발 노력
지금까지 설명한 치료제는 어디까지나 이미 바이러스에 감염된 사람들을 대상으로 사용되는 약물이며 궁극적인 바이러스의 퇴치를 위해서는 감염을 사전 예방하는 백신의 개발이 필수적이다. 특히 2019년 말부터 급속히 전세계적인 범유행이 되버린 SARS-CoV-2에 대한 백신의 개발에 많은 사람들의 관심이 집중되고 있다. 과연 코로나-19를 예방할 수 있는 백신은 개발될 수 있으며, 개발 가능하다면 과연 언제쯤이면 개발 가능할까?
사실 맨 처음 알려진 코로나바이러스인 조류 전염성 기관지염 바이러스(Infectious Bronchitis Virus, IBV)에 대한 백신은 앞에서 이야기한 것처럼 1940년대에 닭 수정란에서 계대배양하여 독성을 잃은 약독화된 바이러스를 찾는 방식으로 개발되었다. 그러나 이러한 고전적인 방법으로 약독화된 바이러스를 얻는 것은 최소 몇 년의 시간이 걸리는 일이기 때문에 코로나-19와 같이 시급한 상황에서는 대처할 수 없다는 문제점이 있다. 바이러스를 배양하여 포르말린 등으로 불활성화하는 경우에도 안전성 평가를 위한 동물시험 등의 과정을 생각하면 지금 당장의 유행을 막기에는 너무나 시간이 걸리는 프로세스이다. 스파이크 단백질(Spike Protein)과 같은 재조합 항원을 생산하여 이를 백신의 항원으로 사용하는 것도 생각해 볼 수 있으나, 이 역시 얼마나 빠른 시간안에 재조합 단백질을 생산하여 최적화하고, 이에 대한 안전성 및 효능 평가를 하는 과정을 생각하면 한시가 급한 상황에서 그닥 빠르게 후보 백신이 나올 수 있는 방법은 아니다.
그래서 최대한 빠른 시간내에 백신을 개발하기 위하여 여러가지 새로운 방법이 시도되고 있다. 가장 빠른 시간내에 백신의 임상 시험에 들어간 것은 체내에 mRNA를 전달하여 단백질을 발현시키는 플랫폼을 가지고 있는 바이오텍 모더나(Moderna Inc)였다. 이들은 SARS-CoV-2 의 스파이크 단백질 유전자 mRNA를 그들의 mRNA 전달 플랫폼인 리피드 나노파티클(Lipid Nanoparticle)을 이용하여 세포 내로 전달하고, 이에 의해서 만들어진 스파이크 단백질이 항원으로 작동한다는 원리의 백신을 2020년 3월부터 임상 1상에 들어갔다. 이들의 mRNA 백신은 아직 코로나바이러스에서 검증된 적은 없지만 인간 대상으로 인플루엔자 바이러스에 대한 백신은 시험되어, 안전성과 면역 유도가 가능하다는 것이 2019년 밝혀진 바 있다. 바이러스의 염기 서열이 결정된지 불과 두 달 만에 개발된 이들의 mRNA 백신이 과연 어느정도의 효과가 있을지는 시간이 말해줄 것이다.
이외에도 2020년 3월 현재 약 30여개의 회사가 다양한 방법론을 이용하여 백신을 개발중이다[30]. 여기에는 mRNA 백신 이외에 아데노바이러스와 같은 DNA 벡터를 이용한 DNA 백신, 항원을 결합하는 당단백질인 gp96과 바이러스 단백질을 결합시킨 백신 등의 새로운 방법론을 이용한 백신도 있지만, 포르말린으로 비활성화된 바이러스를 이용한 백신, 재조합 스파이크 단백질을 이용한 백신, 약독화된 바이러스를 이용한 백신 등 이 책에서 다른 바이러스에 대한 백신을 개발할 때 사용되었던 고전적인 방법론을 이용한 방법도 시도되고 있다.
사실 SARS-CoV/MERS-CoV에 대한 백신이 아직 개발되지 않았던 것은 이들 코로나바이러스 질병이 시급하게 백신을 요구할 만큼 전세계적으로 재발하지 않았던 데에도 이유가 있지만, 기존의 방법론을 이용한 코로나바이러스 백신 개발이 그다지 효과적이지 않았기 때문이다. 가령 SARS-CoV나 MERS-CoV을 기존의 방법론, 즉 스파이크 단백질이나 바이러스를 불활성화되는 백신으로 실험동물을 면역하면 성공적으로 바이러스를 중화하는 항체 형성이 이루어졌고, 바이러스를 감염시키면 백신을 접종받지 않은 실험동물에 비해서 바이러스 수준도 떨어졌다. 그러나 문제는 백신을 접종받은 동물에서도 대조군과 비슷한 수준으로 폐 손상이 일어나는 것이 관찰되었다.[31] 왜 중화 항체를 생성하는 실험동물에서도 폐 손상이 일어날까? 2019년 MERS-CoV를 이용한 실험에서 이의 원인이 될 수 있을 사실이 밝혀졌다. MERS-CoV의 스파이크 단백질로 만들어진 백신을 접종받아 바이러스스파이크 단백질에 결합하는 항체가 미리 존재하는 원숭이에서 바이러스는 항체에 결합하여 세포 내로 침투하지 못하지만, 이는 면역세포인 마크로파지(macrophage)에 의해서 인식되어 선천면역 반응을 유발하고, 이에 의해서 폐 손상이 일어난다는 것이다[32]. 이러한 현상은 기존의 방법론을 이용하여 SARS-Cov-2를 비롯한 코로나바이러스에 대응한 백신을 만드는 것은 기대만큼 쉽지 않을 것이라는 것을 암시해 준다
백신을 만드는 또 다른 전략은 약독화된 바이러스를 이용한 전략이다. 자연적으로 일어나는 돌연변이를 이용한 약독화된 바이러스를 만드는 것은 시간이 걸리는 일이지만, DNA 형태로 재조합 코로나바이러스 유전체가 확보된다면, 코로나바이러스를 이용하여 특정한 유전자를 없애서 증식력을 약화시킨 변형 코로나바이러스를 손쉽게 만들 수 있다. 가령 코로나바이러스 유전자 중의 하나인 E 유전자가 없어진 코로나바이러스는 바이러스 복제 자체는 가능하지만 숙주에서의 증식력이 약 1,000분의 1 로 감소한다는 것이 알려져 있다[33]. 그렇다면 이러한 변형 바이러스는 약독화된 바이러스로 백신으로 작용할 수 있을 것이라는 기대가 있었다. 유전자가 없어진 SARS-CoV/MERS-CoV는 성공적으로 실험동물을 야생형 바이러스로부터 보호해 주었다[34]. 이러한 약독화된 바이러스를 이용한 백신은 두 가지 잠재적인 단점이 있는데, 하나는 야생형 바이러스와의 교잡 등으로 전염성을 다시 획득할 가능성을 배재할 수 없으며, 두번째는 약독화 바이러스를 백신으로 사용하기 위해서는 살아 있는 바이러스를 유지해야 하므로 냉장 유통 과정이 확립되어야 한다는 것이다.
어쨌든 코로나-19 를 예방할 수 있는 백신은 여러가지 가능성이 연구되고 있지만 세계적인 코로나-19 확산이 계속되고 있는 2020년 초 현재에는 가까운 장래에 등장하기는 어렵고 백신 개발 과정의 모든 과정이 순조롭게 끝난다고 하더라도 최소 1년 반 이상의 시간이 걸릴 것이라는 것이 백신 전문가들의 공통적인 의견이다.
2020년 초의 코로나-19의 전세계적인 대유행은 인류가 바이러스와의 전쟁을 정말로 유리하게 이끌고 있는지에 대한 근본적인 회의를 가지게 한 일대 사건이다. 지금까지 많은 바이러스와의 전쟁에서 큰 희생을 치루었지만 이제 대부분의 바이러스에 대한 치료법과 예방법을 확립했다고 생각하던 인류에게 아직도 바이러스로부터의 위협은 상존하며, 전세계적인 대유행을 낳을 수 있다는 것을 여실히 보여주었다. 그리고 아직도 바이러스에 의해서 발생하는 질병에 대한 기전과 치료제에 대한 연구는 지속적으로 계속되어야 한다는 것을 명확하게 보여준 예라고 할 수 있을 것이다.
참고문헌
28. Cao, B., Wang, Y., Wen, D., Liu, W., Wang, J., Fan, G., ... & Li, X. (2020). A trial of lopinavir–ritonavir in adults hospitalized with severe Covid-19. New England Journal of Medicine.
29. Chen, X., Zhao, B., Qu, Y., Chen, Y., Xiong, J., Feng, Y., ... & Ding, J. (2020). Detectable serum SARS-CoV-2 viral load (RNAaemia) is closely associated with drastically elevated interleukin 6 (IL-6) level in critically ill COVID-19 patients. medRxiv.
30. World Health organization, DRAFT landscape of COVID-19 candidate vaccines – https://www.who.int/blueprint/priority-diseases/key-action/novel-coronavirus-landscape-ncov.pdf?ua=1
31. Agrawal, A. S., Tao, X., Algaissi, A., Garron, T., Narayanan, K., Peng, B. H., ... & Tseng, C. T. K. (2016). Immunization with inactivated Middle East Respiratory Syndrome coronavirus vaccine leads to lung immunopathology on challenge with live virus. Human vaccines & immunotherapeutics, 12(9), 2351-2356.
32. Liu, L., Wei, Q., Lin, Q., Fang, J., Wang, H., Kwok, H., ... & Wu, T. (2019). Anti–spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection. JCI insight, 4(4).
33. DeDiego, M. L., Álvarez, E., Almazán, F., Rejas, M. T., Lamirande, E., Roberts, A., ... & Enjuanes, L. (2007). A severe acute respiratory syndrome coronavirus that lacks the E gene is attenuated in vitro and in vivo. Journal of virology, 81(4), 1701-1713.
34. Almazán, F., DeDiego, M. L., Sola, I., Zuñiga, S., Nieto-Torres, J. L., Marquez-Jurado, S., ... & Enjuanes, L. (2013). Engineering a replication-competent, propagation-defective Middle East respiratory syndrome coronavirus as a vaccine candidate. MBio, 4(5), e00650-13.







