기사본문
'식물세포 기반' 프로탈릭스, 2nd 치료제 FDA 'BLA 제출'
입력 2020-06-02 17:41 수정 2020-06-02 20:19
바이오스펙테이터 서윤석 기자

이스라엘 바이오텍 프로탈릭스 바이오테라퓨틱스(Protalix BioTherapeutics)가 미국 식품의약국(FDA)에 희귀질환인 파브리병(Fabry disease) 치료제 후보물질에 대한 생물의약품 허가신청서(biologics license application, BLA)를 제출했다.
프로탈릭스는 동물세포보다 저렴하고, 상온에서 안정적으로 약물을 생산할 수 있는 장점을 가진 식물세포를 사용해 치료제를 개발 및 생산하는 회사다.
프로탈릭스는 지난달 28일(현지시간) 미국 FDA에 희귀 유전질환인 파브리병 치료제 후보물질 ‘PRX-102(pegunigalsidase alfa)’의 가속승인 절차를 위한 BLA를 제출했다고 밝혔다. 프로탈릭스는 2018년 FDA에서 PRX-102에 대해 패스트트랙으로 지정받은 바 있다. 프로탈릭스의 PRX-102는 키에지 그룹의 사업부문 중 하나인 키에지 국제 희귀질환(Chiesi global rare disease)과 공동개발한 약물이다.
파브리병(Fabry Disease)은 인구 4만~6만명당 한명에서 발병하는 X-염색체 연관 희귀 유전병으로 리소좀에 α-갈락토시다제-A 효소(α-Galactosidase-A enzyme)의 손상에 의해 유발된다. 파브리병은 신체 전반에 걸쳐 혈관벽에 Gb3(globotriaosylceramide)라는 지방 물질의 비정상적인 축적을 유발하고, 이로 인해 말초 감각의 손상과 통증에서부터 신장, 심장, 뇌 혈관 등의 장기 손상을 일으킨다.
프로탈릭스는 식물세포에서 생산한 단백질 약물에 대해 FDA에서 승인받은 첫 회사다. 프로탈릭스는 2012년 FDA에서 고셔병(Gaucher disease)에 대한 효소 교체요법(Enzyme Replace Therapy, ERT) 치료제로 당근세포(carrot cell)에서 만든 '엘레라이소(ELELYSO™, taliglucerase alfa)'를 승인받았다.
이번에 허가절차에 들어간 프로탈릭스의 ‘PRX-102’는 담배세포(tobacco cell)에서 생산한 약물로 α-갈락토시다제-A 효소의 페길화(PEGylation)을 통해 체내 안정성을 증가시킨 형태다. FDA에서 승인받으면 프로탈릭스의 두번째 식물세포 기반 약물이 된다.
드로르 바샨(Dror Bashan) 프로탈릭스 CEO는 “PRX-102를 가속승인 절차로 BLA를 제출할 수 있도록 도와준 FDA에 감사하다”며 “키에지와 함께 이번 마일스톤이 가능하게 해준 연구자들과 임상 참여자분들께 감사의 인사를 전한다”고 말했다.
◆PRX-102, 임상 3상에서 "eGFR, Gb3 수치 개선"
담배세포에서 생산한 PRX-102의 임상결과를 알아보자. 프로탈릭스는 파브리병을 앓고 있는 환자 22명을 대상으로 PRX-102의 임상 3상(NCT03018730)의 중간분석결과를 지난달 11일 발표한 바 있다. 프로탈릭스는 기존에 파브리병 치료제로 사용되는 다케다의 ‘레프라갈(Replagal, agalsidase alfa)’로 최소 2년간 치료 중인 환자를 모집해 PRX-102를 2주에 1회씩 12개월간 정맥투여했다.
프로탈릭스는 파브리병환자에게 PRX-102를 투여한 결과, 신장의 기능을 나타내는 연간 추정 사구체여과율(estimated glomerular filtration rate, eGFR) 평균 수치와 혈장내 Gb3 농도를 개선하고 안전성을 확인했다. 구체적으로 PRX-102를 투여한 남성환자의 경우 연간 eGFR수치가 -6.36mL/min/1.73m^2에서 -1.73mL/min/1.73m^2로, 여성환자의 경우 -5.03mL/min/1.73m^2에서 -0.21mL/min/1.73m^2로 개선됐다. 또, PRX-102는 혈장내 Gb3 농도를 남성환자와 여성환자에서 각각 51.81nM→19.55nM(32.35%), 13.81nM→4.57nM(29.81%)로 감소시켰다.
프로탈릭스는 PRX-102가 우수한 약물안전성을 보였다고 설명했다. 임상에 참여한 22명의 환자 중 2명은 과민반응으로 인해 약물 투여를 중단했으나, 20명은 12개월간의 치료를 마쳤다. 프로탈릭스는 임상을 마친 환자 중 18명은 장기간 임상연구로 전환해 PRX-102로 계속 치료하기로 결정했다고 밝혔다.
기존에 파브리병에 대해 승인받은 약물로는 사노피의 ‘파브라자임(Fabrazyme)’, 다케다의 ‘레프라갈(Replagal)’, 아미쿠스(Armicus)의 ‘갈라폴드(Galafold)’가 있다. 프로탈릭스의 PRX-102는 파브라자임, 레프라갈처럼 α-갈락토시다제-A 효소에 대한 효소교체요법(ERT) 방식의 치료제로 2주마다 병원을 방문해 정맥투여를 받아야 한다. 프로탈릭스는 현재 사노피의 파브라자임과 효과를 직접 비교(head to head)하는 임상 3상(NCT02795676)을 진행 중으로 2021년 중간 결과를 발표할 계획이다.

▲PRX-102 임상 3상에서 eGFR과 Gb3 변화(프로탈릭스 발표자료 참조)
◆식물을 이용한 단백질 의약품 생산
식물세포에서 단백질 의약품을 생산하기 위해서는 먼저 식물에 원하는 단백질을 발현시켜야 한다. 이를 위해 일반적으로 아그로박테리움(agrobacterium)을 이용한다. 아그로박테리움은 식물의 형질전환에 사용해온 균주로 평상시엔 식물에 기생하면서 자기에게 필요한 영양분을 얻는다. 그러나 식물에 상처가 날 경우 아그로박테리움은 식물에 침투해 들어가 식물의 DNA를 조작한다. 이런 성질을 이용해 의약품으로 사용하기 위한 단백질을 암호화하는 DNA를 식물에 집어넣는다.
일반적으로 많이 사용하는 담배 식물은 성장 속도가 40일 정도로 빠르고 바이오매스가 많아 다른 식물에 비해 약물을 대량으로 만들 수 있다.
맵 바이오파마슈티컬(Mapp Biopharmaceutical)는 이런 특성을 이용해 담배식물인 니코티아나 벤타미아나(Nicotiana benthamiana)에서 만든 에볼라바이러스 중화항체 지맵(ZMapp)에 대해 2014년 FDA에서 치료제로 승인받았다.
프로탈릭스는 식물세포 배양를 통한 약물생산이 동물세포에 비해 여러 장점이 있다고 강조한다. 먼저, 동물세포보다 비용면에서 저렴하다. 동물세포를 사용해 생산하는 젠자임(Genzyme)의 고셔병치료제 ‘세레자임(Cerezyme, imiglucerase)’에 비해 프로탈릭스의 엘레라이소는 25% 저렴하다. 다음으로 인간에게 감염되는 바이러스의 오염(contamination)없이 상온에서 간단한 제조공정으로 약물을 생산할 수 있다. 동물세포를 사용할 경우 바이러스의 오염을 배제하기 위해 숙련된 기술자와 대규모 설비가 필요하다. 마지막으로 필요한 경우 신속하게 대량생산(horizontal scale-up)이 가능하다.
형질전환 식물을 만들거나 식물에 특정 유전자를 일시적으로 발현시켜 의약품을 생산하는 방식은 식물세포를 배양하는 방식에 비해 생산용량이 적고, 단백질 추출양이 적은 단점이 있으나 생산 절차가 간단하고 빠르며, 단백질의 분리 및 정제가 간단하고, 환경에 대한 규제가 적은 장점이 있다(doi: 10.4155/pbp.14.32). 이런 방식은 평상시에 기르고 있던 식물에 필요에 따라 유전자를 발현시켜 신속하게 의약품을 생산할 수 있다. 예를 들어 캐나다 메디카고(Medicago)는 평상시에 식물을 기르다가, 독감이나 기타 전염병이 대유행을 하게 될 경우 1주에 최대 150만도즈의 백신을 생산할 수 있다(doi: 10.1186/s13104-015-1157-1).
국내의 지플러스생명과학은 CRISPR 유전자 편집기술을 이용해 식물에서 면역 항암 바이오베터 의약품 개발을 진행하고 있다. 지플러스는 동물세포에서 생산되는 항체보다 효능은 높이고 부작용은 낮춘 항체 바이오베터를 식물에서 만들어, 저렴한 비용으로 고품질 의약품을 제공하는 것을 목표로 하고 있다.
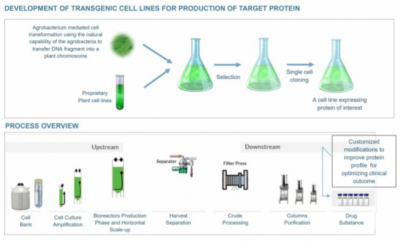
▲프로탈릭스의 식물세포 배양을 통한 단백질 생산 과정(프로탈릭스 발표자료 참조)






