기사본문
인텔리아, 'in vivo CRISPR' ATTR 1상 중간 “효능지속”
입력 2022-03-04 12:04 수정 2022-03-04 12:36
바이오스펙테이터 노신영 기자

인텔리아(Intellia Therapeutics)가 ‘in vivo’ CRISPR 기반으로 개발중인 트랜스티레틴 아밀로이드증(ATTR Amyloidosis) 치료제 ‘NTLA-2001’이 단일투여 후 추적관찰에서도 질병단백질 트랜스티레틴(transthyretin, TTR)의 축적을 감소시킨 긍정적 데이터를 보였다.
ATTR 아밀로이드증은 트랜스티레틴 유전자(TTR gene) 돌연변이로 인해 TTR 단백질이 잘못접힌(misfolding) 구조로 합성되어 발병한다. 비정상 TTR 단백질은 체내 아밀로이드의 축적을 유도해 심장, 신경계, 소화계 등 조직에 심각한 합병증을 유발한다.
인텔리아의 ‘NTLA-2001’은 CRISPR/Cas9 시스템을 통해 비정상 TTR 유전자를 녹아웃(Knock-out) 시켜, 잘못접힌 TTR 단백질의 합성을 억제함으로써 질환을 개선하게 된다. 이에 인텔리아는 리제네론(Regeneron Pharmaceuticals)과 파트너십을 체결해 지난 2016년부터 NTLA-2001을 포함한 in vivo CRISPR 프로그램을 공동개발하고 있다.
인텔리아와 리제네론은 지난달 28일(현지시간) ATTR 아밀로이드증(amyloidosis) 환자를 대상으로 CRISPR 치료제 후보물질 NTLA-2001을 평가한 임상 1상의 추적관찰 중간결과를 발표했다.
유전성(Hereditary) ATTR 아밀로이드증은 아밀로이드가 축적되는 조직에 따라 증상이 다르게 나타나는데, 아밀로이드가 신경계에 축적되면 다발성신경병증(polyneuropathy, ATTRv-PN)으로 진단되며, 심장조직에 축적되면 심부전을 일으킬 수 있는 심근증(cardiomyopathy, ATTRv-CM)으로 진단된다.
인텔리아가 진행한 임상 1상은 ATTRv-PN, ATTRv-CM 및 노화로 발병하는 야생형 ATTR 아밀로이드증 환자(ATTRwt)를 대상으로 NTLA-2001의 용량에 따른 내약성, 안전성 및 PK/PD를 평가한 임상이다(NCT04601051). 이번에 발표된 데이터는 그 중 ATTRv-PN 환자를 대상으로 평가된 중간결과다.
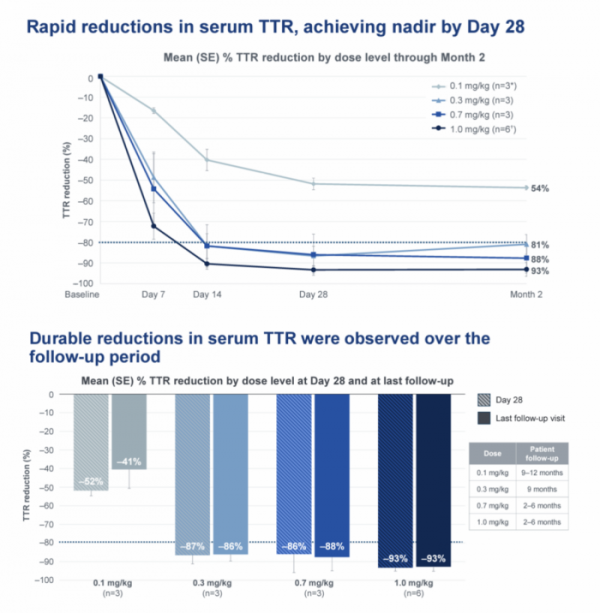
임상은 ATTRv-PN 환자 15명을 대상으로 NTLA-2001 투여용량에 따라 0.1 mg/kg(3명), 0.3 mg/kg(3명), 0.7 mg/kg(3명), 1.0 mg/kg(6명) 등 4개 코호트로 구분해 평가를 진행했다. NTLA-2001을 해당 용량에 따라 1회 정맥투여한 뒤 최대 24개월의 추적관찰 기간동안 기준선(basline) 대비 환자 혈청 내 TTR 단백질 수치 변화와 안전성 등을 평가하게 된다.
임상결과 NTLA-2001를 투여받은 환자들은 투여용량에 따른 혈청 내 TTR 단백질 감소를 보였다. 추적관찰 28일차에 0.1mg/kg, 0.3mg/kg 및 0.7mg/kg 코호트의 TTR 단백질 수치는 각각 평균 52%, 87%, 86% 감소했다.
최대용량인 1.0 mg/kg 투여 코호트의 환자는 추적관찰 28일차에 93%까지 감소했다. 특히 1.0mg/kg 코호트 환자 6명의 혈청 내 TTR 단백질 수치는 모두 80% 이상 감소했으며 그 중 4명은 추적관찰 28일차에 TTR 단백질 수치가 90% 이상 감소했다. 0.3mg/kg 이상의 용량으로 NTLA-2001를 투여받은 모든 코호트는 추적관찰 기간동안 감소된 TTR 단백질 수치가 유사한 수준으로 유지됨을 확인했다.
NTLA-2001은 4개 코호트에서 일반적으로 내약성이 우수했다. 환자 73%(11명)에게서 1등급의 부작용이 보고됐으며 대부분의 부작용은 경미한 수준으로 확인됐다. 가장 자주 보고된 부작용은 두통, 주사부위 통증, 요통 및 메스꺼움이 있었으며, 주요 간 부작용은 관찰되지 않았다. 이전에 위 마비(gastroparesis) 병력이 있었던 1.0mg/kg 코호트 환자 1명에게서 3등급 구토 부작용이 보고됐으며, 그 외 1.0mg/kg 코호트에서 2등급 이상의 부작용이 보고된 환자는 없었다.
존 레오나드(John Leonard) 인텔리아 CEO는 “이번 임상데이터는 단회 투여 전신순환 CRISPR 치료제가 질병유발 단백질 수준을 실질적으로 감소시킬수 있다는 가능성을 보여준다”라며 “NTLA-2001에 대한 진행 중인 인간 최초 임상데이터는 혈청 TTR 단백질의 빠르고 깊고 지속적인 감소를 보였다. 우리는 이러한 단백질의 감소가 ATTR 아밀로이드증 환자의 질병진행을 멈추고 심지어 역전시킬 가능성이 있을것으로 기대한다"고 설명했다.
한편 인텔리아는 이번 임상 1상의 파트2 용량확장(Dose Expansion) 시험을 올해 1분기에 진행할 계획이다. 또한 인텔리아는 임상 1상의 ATTRv-CM 환자를 대상으로 NTLA-2001에 대한 평가를 진행하고 있으며, 올해 말 학회에서 이번 임상의 추가데이터를 발표할 계획이다.
▲(인텔리아 ATTR 아밀로이드증 임상 1상 결과자료 캡쳐)







