기사본문
기존 항암치료 효과에 대한 세계적 석학의 의문 제기
입력 2016-09-28 11:12 수정 2017-03-21 14:46
바이오스펙테이터 김성민 기자
암환자들이 약물, 방사선 등 고통스러운 항암치료를 받고 그 덕분에 종양이 감소하는 등 암이 치료되는 것처럼 보이지만 오히려 그 치료가 암의 유전적 불안정성을 증가시켜 결국엔 종양의 성장을 가속화할 수도 있다는 세계적 석학의 발표가 있었다. 특히 그 발표에는 암 환자가 치료를 받거나 그렇지 않거나 전체 생존기간에는 큰 차이가 없을 수 있다는 내용까지 덧붙었다.
그렇다면 우리는 암에 걸렸을 때 어떤 선택을 해야하는 것일까? 수많은 항암치료를 하고 있는 현재의 암치료 방법은 정말 유효한 것일까? 그리고 그에 들어가는 엄청난 비용은 또 어떻게 봐야하는 것일까? 이번 발표는 기존 항암치료에 대한 근본적인 질문을 던진다. 또한 이는 연구진으로하여금 기존 항암치료를 극복하기 위한 새로운 도전에 나서게 하는 하나의 채찍이기도 하다.
프랜시스 클릭 연구소 Charles Swanton 교수가 지난 9월 24일 영국 런던 Molecular Analysis for Personalized therapy meeting(MAP)에서 발표한 자료에 따르면 일반적으로 시간이 지나면서 암 환자의 종양크기가 점점 커지는데, 특정 약물을 처리했더니 잠시 종양성장이 억제되는 것처럼 보이다가 어느 시점에서 전보다 훨씬 빠른 속도로 성장한다는 것. 이렇게 특정약물에 대해 항암치료를 받은 암환자의 종양은 결국 아무런 치료를 받지 않은 암환자의 종양을 대변하는 그래프와 만나면서 ‘결국 암환자의 사망시점은 큰 차이가 없다는 것'이다.
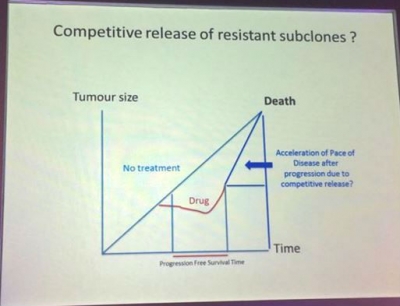
▲출처: MAP 학회 Charles Swanton 교수의 발표자료
물론 모든 항암 치료제에 대해 종양이 이렇게 반응한다는 것은 아니다. 또한 자세히 따져보면 병이 걸리고 죽는 시점인 전체 생존기간(OS, overall survival)은 큰 차이가 없지만 병기가 잠시 멈춘 무진행 생존기간(PFS, progressive free survival)은 늘어난 것처럼 단순히 차이가 없다고 말할 문제는 아니다. 그럼에도 불구하고 이러한 질문들은 앞으로의 항암치료 방향에 대해 시사하는 바가 있다.
Charles Swanton 교수는 종양내 이질성(intra heterogeneity)분야의 세계적 석학으로 그가 주장하는 핵심은 암종양 내의 유전적 불안정성(genetic instability)로 인해 유전자에 높은 변이(mutation)이 일어나고, 이러한 변이가 암과 대항하는 데 큰 어려움을 겪게 한다는 것. 종양도 다윈이 말한 진화론처럼 ‘다양성’ 덕분에(?) 끈질기게 살아남는다는 것이다.
Charles Swanton 교수 연구진은 좀 더 거시적인 관점으로 종양내 이질성(heterogeneity)를 분석하기 위해 환자 고형암을 조직학적 특징에 따라 부위를 나누고 유전자 서열분석, 염색체 이상분석을 했다. 그 결과 특정 단백질의 표현형과 유전형이 관련성이 있음을 규명해 하나의 종양 안에서도 끊임없이 체세포 돌연변이가 나타남을 확인했다.
이러한 현상은 항암치료에서 ‘특정 항암제에 대한 내성이 생긴다’라는 개념으로 빈번하게 관찰된다. 2015년 기준 7조원 규모의 시장을 갖고 있는 고형암치료제 아바스틴(Avastin)의 가장 큰 한계는 내성이 생긴다는 것이다. 아바스틴은 암미세환경에 산소와 영양분을 공급하기 위해 생기는 신생혈관을 억제하는 항체로 VEGF-a를 막는다. 일시적으론 고형암의 크기가 줄어드는 것처럼 보이지만 암세포는 절대 그냥 물러서지 않는다.
주요 신호 전달이 차단될 경우, 풍선효과(balloon effect)로 VEGFR-b, c, d, e와 같은 다른 혈관생성 인자가 과활성화 돼 아바스틴의 작용을 무력화시킨다. 때문에 실제환자에서도 아바스틴을 단독으로 쓰기보단 병용요법으로 증상을 완화하는 용도로 쓰이며 내성이 생겨 다른 약물로 교체를 하는 경우가 발생한다.
아바스틴과 같이 글로벌 탑10 의약품에 속하는 허셉틴도 예외는 아니다. 항암제는 계속 발달하고 있지만 단독으로는 암세포가 진화∙변이하는 속도에 따라오지 못하기에 결국 내성이 생긴다는 것. 이에 Charles Swanton 교수는 한 인터뷰에서 ‘타깃치료에 대한 저항성은 마치 항생제에 저항성이 생기는 것과 비슷하다’고 언급했다.
일반적으로 쓰이는 비소세포폐암 표적치료제 타세바(Tarceva, 로슈)도 표피성장인자 활성에 영향을 주는 물질인데 약효는 좋지만 투약 후 1년 내에 높은 내성을 가진다는 한계점이 있다. 이외 항암제 내성에 대한 예는 많다.
안성환 지노믹트리 대표는 이러한 현상을 조직폭력 집단을 비유해 설명했다. 조직폭력배 중에는 다양한 집단이 있을 것이며 특히 세력이 쎈 집단이 있을 것이다. 암조직도 이와 비슷하다. 하나의 조직폭력 집단처럼 암종양도 같은 기원을 가진 클론(clone)이 있으며, 주 세력이 범죄를 소탕할 때 첫번째 타깃이 되는 것처럼 주요 클론이 먼저 항암치료제의 표적이 되는 것이다. 하지만 이를 통해 다른 클론들은 세력을 키울 힘을 가지게 된다. 암 조직의 이질성(heterogeneous)은 비단 클론뿐 아니다. 같은 클론 안에도 굉장히 다양한 유전적 변이를 지닌 암세포가 공존하고 있다.
이러한 집단 내에서 항암제를 처리할 경우 일시적으로는 타깃한 클론이 없어지지만 결국 다른 치료가 필요한 암종양으로 변하는 것이다.
안 대표는 “이는 병목현상에 비유할 수 있다. 항암제와 같은 요소에 의해 큰 압력이 생기면 일시적으로 종의 다양성이 줄어들지만 이에 대한 저항성으로 새로운 세력이 나타나고, 암세포도 특정 클론으로 중심이 옮겨지는 것”이라 전했다.
이러한 새로운 세력의 클론은 어디서 기인되는 것일까? 여기에는 두 가지 관점이 공존한다. 첫째는 원래 있었던 클론이 주력 세력이 없어져서 출현할 수도 있고, 둘째는 왕성하게 분열하는 종양세포내에서 약물독성이나 방사선치료 등 항암치료과정을 원인으로 새로운 유전적 혹은 구조적 변이가 생길 수 있는 것이다.
또한 같은 종양세포 안에서도 항암치료에 대한 다른 저항성을 가질 수 있다. 암줄기세포(tumor initiating cell)라는 개념이 있는데, 이는 암 전이∙재발에 핵심적 역할을 하며 항암치료에 저항성을 가지는 특성을 갖고 있다고 알려져 있지만 아직 명확하게 규명된 개념은 아니다.
실험실에서 세포배양을 할 때 가장 많이 사용하는 것이 무한증식하는 특징을 가진 헬라 세포주(암 환자의 조직에서 기원한)로 과학 연구에서 가장 오래되고 흔하게 사용되는 세포주이다. 잘 자랄 뿐 아니라 하나의 세포에서 기원했기에 모두 같은 세포라는 전제하에 실험을 한다. 하지만 안 대표는 ‘각각의 세포를 유전자 수준에서 분석해 보면 다 다르다는 것’으로 생물 다양성을 강조했다.
유진산 파멥신 대표는 최근 미래에셋대우 본사에서 열린 기업강연에서 "항암제를 처리했을 때 주요 기전을 막으면 암세포가 죽을 것이라고 생각했지만 90%는 죽어도 10%는 남아 환자를 사망에 이르게 한다"며 "그렇기에 항암치료에 면역관문억제제를 병용투여하는 것처럼 Plan A, B를 동시에 노리는 접근 방법이 필요하다"고 전했다.
이처럼 암세포는 같은 환자의 암 종양 내에서도 다양성을 가지며 또 굉장히 빠른 속도로 살아남기 위해 변이를 일으키며 진화를 거듭하는 것으로 바이오의약품으로 항체 의약품, 바이오시밀러, 특정 항원을 타깃하는 세포치료제가 개발되고 있는 상황에 '암을 정복하기 위해' 분명 고려해봐야 할 문제다.







