기사본문
2017년 FDA 허가 신약 살펴보니..희귀·항암제 강세
입력 2017-07-07 14:34 수정 2017-07-07 14:34
바이오스펙테이터 장종원 기자
올해 상반기 미국 FDA 관문을 넘은 신약이 총 22건으로 집계됐다. 지난해 허가받은 전체 신약 건수와 동일한 것으로 이중 희귀의약품과 항암제가 절반 이상을 차지할 정도로 비중이 높았다. 특히 다발성경화증 치료제 오크레버스(Ocrevus)와 아토피 치료제 듀픽센트(Dupixent)는 블록버스터로 성장 가능성이 높다는 평가를 받았다.
7일 업계에 따르면 FDA는 1월 성인 만성 특발성 변비치료제 트루란스(Trualance)를 시작으로 6월 급성 박테리아 피부 감염 치료제(항생제) 백스델라(Baxdela)까지 총 22건을 허가했다.
비정상적으로 신약 승인이 급감했던 지난해의 충격에서 벗어난 모습이다. 지난해는 2014년 45개, 2015년 41개 신약 허가에 비해 절반 수준에 불과하고 2005∼2015년 평균 28개의 신약 승인 건수보다 낮은 수치를 기록했다. "제약업계의 연구개발 생산성이 하락된 게 아닌지 우려스럽다"는 평가가 나올 정도였다.
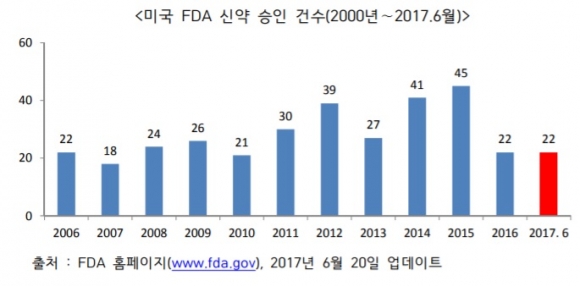
▲생명공학정책연구센터 제공.
올해는 희귀의약품과 항암제를 중심으로 신약 승인 건수가 늘면서 전체 숫자도 늘었다. 뒤시엔느 근이영양증 치료제 엠플라자(Emflaza), 루게릭병 치료제 라디카바(Radicava), 소아 희귀질환 '배튼병' 치료제인 브리뉴라(Brineura), 헌팅턴 무도병 치료제 오스테도(Austedo) 급성 골수성 백혈병 치료제 라이답트(Rydapt) 등이 대표적이다.
특히 엠플라자의 경우 개발사인 마라톤 테라퓨틱스가 1년 치료비용으로 8만 9000달러라는 높은 가격을 책정함에 따라 미 대선 약가 논쟁을 촉발시키기도 했다. 현재 PTC 테라퓨틱스가 제품을 인수해 출시를 준비하고 있다.
항암제로는 PD-L1 억제 방광암 치료제인 임핀지(Imfinzi), 전이성 메켈세포암·방광암 치료제 바벤시오(Bavencio) 유방암 치료제 키스칼리(Kisqail) 재발성 난소암 치료제 제줄라(Zejula) 등이 신약 대열에 합류했다.
특히 다발성경화증 치료제 오크레버스(Ocrevus)와 아토피 치료제 듀픽센트(Dupixent)는 차세대 블록버스터로 주목받는다. 시장조사기관 이벨류에이트파마 2017년 보고서에 따르면 오크레버스는 2022년 전세계 시장에서 40억 8800만달러, 듀픽센터는 49억 3800만달러의 매출을 올릴 것으로 전망했다.
생명공학정책연구센터는 최근 보고서에서 트럼프 정부가 FDA의 신약 승인 관련 규제를 전례없는 수준으로 대폭 철폐, 완화할 방침이어서 신약 승인은 가속화될 것으로 전망했다. 다만 소비자보호단체, 과학계, 제약업계조차 등은 효과가 입증되지 않은 의약품 등을 쉽게 승인해줘 시민들을 위험에 빠뜨릴 수 있다고 우려를 표하고 있다고 전했다.

▲생명공학정책연구센터 제공.







