기사본문
블루버드, 다발성골수종 CAR-T 1상결과 "반응률 94%"
입력 2017-12-11 14:44 수정 2017-12-11 14:44
바이오스펙테이터 이은아 기자
다발성 골수종 치료를 위한 CAR-T 치료제 임상시험에서 획기적인 임상결과가 도출됐다. 블루버드바이오(Bluebird bio)가 셀진(Celgene)과 공동개발 중인 BCMA 타깃 CAR-T 치료제 후보물질 'bb2121'은 임상1상에서 94%에 달하는 전체 반응률(OR)을 선보이며 큰 주목을 받았다. bb2121은 다발성골수종 진행에 중요한 역할을 하는 B세포 성숙화항원(B Cell Maturation Antigen, BCMA)을 겨냥하는 CAR-T 치료제다.
말기 재발·불응성 다발성골수종 환자를 대상으로 한 임상1상 활성용량 코호트(150x10^6, 450x10^6, 800x10^6 cells/patients)에서 94%(17/18명)의 높은 전체 반응률을 확인했을 뿐만아니라 환자 56%(10/18명)가 완전관해(CR)를 나타냈다. 무진행생존기간(PFS) 중간값은 40주간 중간추적 관찰기간동안 도달하지 못했지만 6개월과 9개월의 PFS는 각각 81%, 71%이었다. 또한 미세잔존질환(minimal residual disease, MRD) 상태를 평가한 환자 90%(9/10명)에서 MSD가 관찰되지 않아 재발위험이 낮을 것으로 기대됐다. 미세잔존질환(MSD)는 치료제 투여후 암세포가 소량 남아있는 상태로 미세잔존질환이 있는 환자들은 재발 위험이 높은 것으로 알려져있다.
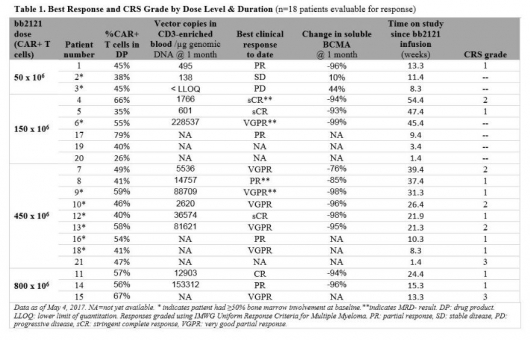
▲제59차 미국혈액학회(ASH)에서 발표한 bb2121의 임상1상 결과(자료:ASH 초록, https://ash.confex.com/ash/2017/webprogram/Paper107984.html)
블루버드바이오는 bb2121의 업데이트된 임상1상 연구(CRB-401)내용을 지난 9일부터 4일간 미국 애틀랜타에서 열린 제59차 미국혈액학회(ASH)에서 발표했다고 10일 밝혔다. 이번 임상1상은 용량 증량(dose escalation) 시험을 통해 안전성과 유효성을 평가하고 임상2상의 용량을 결정하기 위함이었다.
사전에 치료받은 경험이 있는 성인 환자 50명을 대상으로 진행된 CRB-401 임상1상 연구(NCT02658929)는 지난 10월 2일 집결된 데이터 결과까지 21명의 환자가 용량 증량 시험을 위해 50x10^6, 150x10^6, 450x10^6, 800x10^6 세포를 투여받았다. 환자들은 림프구제거(lymphodepletion)요법 이후 사이클로포스파마이드(Cyclophosphamide)와 플루다라빈(fludarabine)의 항암화학요법을 매일 3일간 투여 받은 후 bb2121 세포를 1회 투여받았다.
결과적으로 환자들은 bb2121을 150x10^6, 450x10^6, 800x10^6 세포 투여후 전체 반응률 94%와 완전관해율 56%를 보이며 우수한 결과를 선보였다. 전체 용량증량 시험에 참여한 환자 21명의 안전성 테스트 결과는 어땠을까? 용량증량, 용량확대 시험에 참여한 환자들에서 3/4등급 신경독성 부작용은 관찰되지 않았다. 다만 환자 71%(15/21명)에서 사이토카인 신드롬(CRS) 1등급 및 2등급이 발생했고, 2명의 환자가 3등급 CRS를 경험했다. 그들 중 4명은 토실리주맙(tocilizumab), 1명은 스테로이드제를 투여받자 24시간 내 사이토카인 신드롬이 해결됐다.
3·4등급 부작용으로 호중구 감소증(86%), 빈혈(57%), 혈소판 감소증(43%)을 포함한 림프구제거(lymphodepletion) 요법과 관련된 증상도 있었다. 또한 투여 후 22~69주차에 완전관해를 보였던 두 명의 환자가 각각 심장마비와 골수이형성증후군으로 사망했지만 bb2121과 무관한 것으로 평가됐다.
bb2121은 지난 11월 FDA로부터 ‘획기적 치료제‘로, EMA로부터는 미충족 의학수요를 증진시키기 위해 임상개발을 지원하는 프로그램인 ’Prime‘ 자격을 각각 부여받아 임상시험에 속도를 내고있다. 블루버드바이오와 셀진은 임상1상 결과를 바탕으로 80명 환자를 대상으로 150x10^6 ~ 300x10^6 세포 용량으로 후기임상 연구를 진행할 계획이다.
데이브 데이비슨(Dave Davidson) 블루버드바이오 의학부 총책임자(Chief Medical Officer, CMO)는 “bb2121 임상데이터는 강력한 반응률, 안전성 프로파일을 보이며 다발성골수종 CAR-T 치료제로서 잠재적인 가능성을 확인했다”고 강조했다.
한편 블루버드바이오는 BCMA 타깃 CAR-T 치료제의 선두주자로서 자리매김하는 동시에 차세대 CAR-T 개발에도 앞장서고 있다. 지난 7일 영국 스코틀랜드 소재의 TC BioPharm과 공동개발 협력을 맺으며 감마 델타 T세포수용체의 발현을 조작해 정상인에게 영향을 주지 않으면서 선택적으로 종양세포만 표적으로 하는 업그레이드 형태의 CAR-T세포(ImmuniCAR)를 개발 중이다.
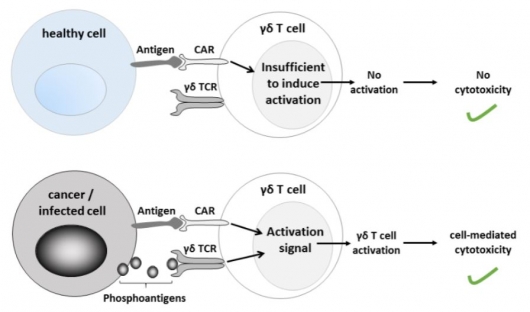
▲블루버드바이오와 TC BioPharm의 차세대 CAR-T 치료제 'ImmuniCAR' (자료: www.tcbiopharm.com)







