기사본문
아블링스, 루푸스치료제 ‘IL-6R 나노바디’ 임상2상 실패
입력 2018-03-27 09:56 수정 2018-03-27 09:56
바이오스펙테이터 이은아 기자

아블링스(Ablynx)의 항 IL-6R 나노바디인 보바릴리주맙(vobarilizumab)의 용량을 설정하기 위한 임상2상 연구에서 실망스러운 결과가 나왔다.
올해 초 사노피가 48억달러에 인수한 아블링스는 전신홍반루푸스(Active Systemic Lupus Erythematosus, SLE) 치료제 후보물질인 보바릴리주맙의 임상시험 중간결과 1차종결점에 도달하지 못했다고 26일(현지시간) 밝혔다.
이번 STEADY 연구는 2015년 8월 시작해 SLE 환자 312명을 대상으로 위약 투여군과 보바릴리주맙 4가지 용량(4주마다 75mg, 4주마다 150mg, 2주마다 150mg, 2주마다 225mg) 투여군으로 분류해 진행됐다. 중간분석 결과 1차평가지표로 평가된 루푸스 평가점수(BILAG-based Composite Lupus Assessment, BICLA)에서 목표 종결점에 도달하지 못한 것이다.
이번 임상결과로 인해 3년 전 보바릴리주맙에 대해 아블링스와 제휴를 맺었던 애브비(AbbVie)는 SLE에서 보바릴리주맙의 권리 취득을 거부할 가능성도 있다. 당시 애브비는 아블링스에 SLE에서 보바릴리주맙의 판권을 취득할 수 있는 권리에 대해 계약금 1억7500만 달러를 지불했으며, 광범위한 염증성질환으로 치료를 확장할 경우 잠재적으로 8억4000만달러까지 지불하는 계약을 맺었다. 그러나 보바릴리주맙가 류마티스성 관절염(RA) 대상 임상2상 결과에서 목표를 달성하지 못하면서 애브비는 RA에서 보바릴리주맙의 권리 취득을 거부한 바 있다.
회사 측에 따르면 보바릴리주맙은 1차종결점은 만족하지 못했지만 58주까지 안전성 프로파일은 우수했다. 치료 관련 심각한 이상반응은 위약군은 6.5%인데 반해 보바릴리주맙 투여군은 전체의 2%에서만 관찰됐다. 심각한 감염을 경험한 환자 비율은 위약군 대비 보바릴리주맙군이 더 낮았다(6.5% vs 2.8%). 다만 약물중단으로 이어진 응급 부작용은 보바릴리주맙군은 12.4%, 위약군은 6.5%에서 나타났으며, 보바릴리주맙 군에서 2명이 사망에 이르렀다.
Robert K. Zeldin 아블링스 CTO는 "우리는 보바릴리주맙이 1차평가변수 분석에서 용량 반응을 보이지 않아 실망스러웠다. 그러나 보바릴리주맙의 모든 용량에서 우수한 내약성과 안전성 프로파일을 확인했다“고 밝혔다.
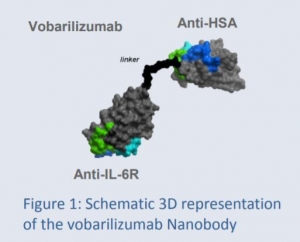
▲Ablynx의 보바릴리주맙(vobarilizumab) (출처: 2017 ACR/ARHP Annual Meeting 포스터)
보바릴리주맙은 IL-6 수용체(IL-6R)을 통해 IL-6 신호경로를 표적한다. 특히, 생체 내 혈청 반감기를 증가시키기 위해 항 인간 혈청 알부민(human serum albumin, HSA)을 나노바디에 연결한 형태다.
아블링스의 나노바디는 낙타와 라마에서 발굴한 항체다. 이 항체는 항원과 결합하는 중쇄부위(heavy chain)을 포함하지만 경쇄부위(light chain)가 없는 단일-도메인 항체 조각을 가지는 독특한 구조다. 기존 항체에 비해 10분의 1의 크기를 가져 투여가 용이하고, 단일가변부위(single variable domain, VHH)을 연결해 최대 7개 타깃까지 겨냥할 수 있다는 장점이 있다.
이러한 나노바디 플랫폼으로 아블링스는 사노피에 인수되기 이전 사노피, 애브비, 베링거인겔하임, 머크, 노바티스, 노보노디스크, 다이쇼제약 등의 글로벌 제약사와 공동 연구개발 파트너십을 구축한바 있다.







