기사본문
[남궁석의 신약개발史]PCSK9 타깃 새로운 시도들
입력 2019-01-15 15:15 수정 2019-01-15 17:25
남궁석 SLMS 대표
지난 연재에서 혈중 LDL 콜레스테롤 대사에 관여하는 새로운 타깃인 PCSK9의 발견과정을 알아보았다. 그렇다면 어떻게 PCSK9의 활성을 억제하여 혈중 콜레스테롤을 억제하는 새로운 클래스의 신약을 개발할 수 있을 것인가?
PCSK9의 활성을 어떻게 억제할 것인가?
스타틴은 HMG 환원효소라는 콜레스테롤 합성의 핵심 단계를 촉매하는 효소의 활성 자리(Active Site)에 결합하는 소분자 물질이었다. 대부분의 효소는 기질과 결합하는 활성 자리가 있고, 이 활성 자리는 분자량이 작은 기질이 단단히 결합할 수 있도록 하는 일종의 단백질에 난 ‘홈’ 과 같은 역할을 한다. 대부분의 소분자 물질은 이러한 ‘홈’에 결합하여 효소의 기능을 저해함으로써 약물로서의 역할을 수행한다.
그러나 세포 외로 방출된 PCSK9는 효소로서 역할을 수행하는 것이 아니라 LDL 리셉터와 결합하여 LDL 리셉터가 LDL과 결합하는 것을 방해하고, 세포내흡수(Endocytosis)로 LDL 리셉터와 함께 흡수된 후 LDL 리셉터가 재사용되는 것을 방해하여 LDL 리셉터가 결국 분해되게 만든다. 즉 PCSK9는 효소 작용이 아닌 LDL 리셉터와의 단백질 상호작용에 의해서 작용한다. 두 개의 단백질이 결합하는 것은 기질과 같은 소분자와 단백질이 결합하는 것보다 훨씬 더 넓은 표면에서의 상호작용에 의해서 이루어진다. 이것은 단백질의 상호작용을 억제하는 소분자 물질을 개발하는 것은 효소를 억제하는 것에 비해서 일반적으로 훨씬 어려운 일이다[1].
따라서 PCSK9의 기능을 억제하는 것은 활성을 억제하는 스타틴이라는 소분자 물질을 탐색하는 HMG 환원효소와는 다른 방식으로 이루어져야 할 필요가 있었다. 그렇다면 어떤 방식으로 PCSK9의 활성을 억제할 수 있을까?
단일 항원 항체에 의한 PCSK9의 억제
PCSK9는 세포 밖으로 방출된 이후, LDL 리셉터와 결합하여 LDL 리셉터의 기능을 조절한다. 그렇다면 PCSK9와 LDL 리셉터의 결합을 억제하는 것이 PCSK9의 기능을 억제하는 최선의 방법이 될 것이며, 이를 위해서는 PCSK9에 특이적으로 결합하는 단일 항원 항체가 PCSK9의 기능을 억제하는 최선의 방법일 것이다.
PCSK9가 혈중 LDL 농도를 낮출수 있는 새로운 타깃으로 확인되자 여러 제약회사들은 앞다투어 PCSK9와 결합하여 LDL 리셉터와의 결합을 억제할 수 있는 단일 항원 항체의 개발에 뛰어들었다. 이들 중 선두주자는 리제네론(Regeneron)과 사노피(Sanofi)가 공동개발한 알리로쿠맙(Alirocumab)과 암젠의 에볼로쿠맙(Evolocumab)이라는 인간유래 항체였다.
2015년 NEJM에 발표된 두개의 임상시험 논문에서 이들 항체들은 기존에 스타틴으로 치료받았지만 여전히 높은 수준의 혈중 LDL콜레스테롤(85-100mg/dl이상)을 유지하는 환자를 대상으로 투여되었다[2]. 에볼로쿠맙과 스타틴을 동시에 투여받은 환자군에서 LDL콜레스테롤은 스타틴만을 투여받은 환자군에 비해서 LDL 콜레스테롤 수준이 61% 낮아졌고, 심혈관질환 발생 위험도는 절반 이상으로 낮아졌다. 알리로쿠맙을 투여받은 환자 역시 비슷한 수준으로 LDL 콜레스테롤과 심혈관질환 위험도가 낮아졌다. 이러한 임상시험 결과를 근거로 FDA는 2015년 에볼로쿠맙과 알리로쿠맙에 대해서 유전성 고콜레스테롤 환자나 LDL 농도를 더 낮추어야 하는 죽상경화증 환자를 대상으로 사용할 수 있도록 허가되었다.
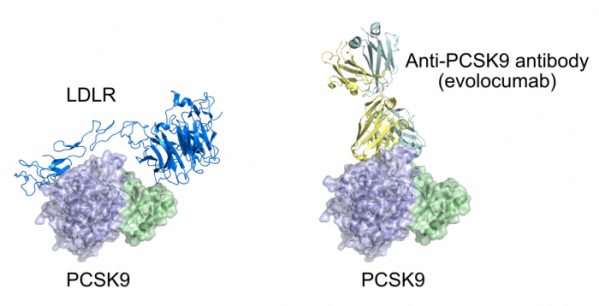
▲그림 1: PCSK9와 LDL 리셉터, Anti-PCSK9 항체와의 결합. PCSK9 는 LDL 리셉터와 결합하여 이들의 형태 변화를 억제하여 LDL 리셉터의 재활용을 막아 궁극적으로 LDL 리셉터를 분해하게 만든다. 에볼로쿠맙과 같은 PCSK9 항체는 PCSK9와 LDLR 와의 결합 부위에 결합하여 PCSK9 의 LDL 리셉터와의 결합을 막는다.
그러나 그때까지의 결과는 스타틴에 PCSK9 항체를 추가하여 LDL 콜레스테롤 수준을 낮추는 것이 과연 유의미하게 심혈관 질환에 의한 사망율을 낮춘다는 것을 입증하기는 충분하지 않았다. 따라서 이를 입증하기 위한 후속 임상시험이 기획되었다. 2017년 발표된 2만7564명의 죽상경화증에 의한 심혈관 환자를 대상으로 한 2.2년간의 추적연구에서 에볼로쿠맙의 의 추가는 스타틴만의 치료에 비해서 약 15-20%의 위험도를 낮추는 것이 확인되었다[3]. 이러한 임상시험 결과에 의해 2017년 FDA는 에볼루쿠맙을 심근경색, 뇌졸증 등의 예방 목적으로 처방하는 것을 허가하였다.
이렇게 PCSK9 항체가 다양한 환자를 대상으로 LDL 콜레스테롤 수준을 낮출 수 있다는 것이 입증되었지만, PCSK9 항체의 폭넓은 임상적 이용을 막는 여러가지 걸림돌이 있다. 첫번째는 경구 투여에 의해서 투약될 수 있는 스타틴에 비해서 항체의약품인 PCSK9는 반드시 병원에 내원하여 주사제 형태로 투약되어야 한다는 것이며, 두번째는 가격의 문제이다. 2015년 출시되었을 때 에볼로쿠맙이나 알리로쿠맙은 1년 투약 비용이 1만4100달러로써, 투약받을 때 얻을 수 있는 질보정 기대여명(Quality Adjust Life Year, QALY) 1년당 약 35만 달러의 비용이 소요되는, 극히 비싼 약인 셈이다[4]. 이는 이들 항체가 항체의약품이라는 생산-개발비용이 많이 드는 의약품이라는 데 기인한다. 2018년 에볼로쿠맙의 개발사인 암젠(Amgen)은 에볼로쿠맙의 1년 투약비용을 5,850달러로 인하하였다. 그러나 질보정 기내여명 1년당의 비용을 10만 달러 정도로 끌어내리기 위해서는 투약비용이 4,536 달러 정도가 되어야 한다는 추산을 감안한다면 PCSK9 항체가 임상적으로 유효한 치료 수단이 되기 위해서는 추가적인 가격 인하기 필요하다는 것이 PCSK9 항체의 앞으로의 관건이 될 것이다.
RNAi / ASO에 의한 PCSK9 의 억제
일차적으로 PCSK9에 대한 항체가 PCSK9의 활성을 억제하는 수단으로 연구되어 이미 임상에 사용되고 있지만, 다른 방법에 의해서 PCSK9를 억제하는 방법 역시 연구되고 있다. 그 중의 하나가 RNA 간섭(RNA interferences)를 이용하여 PCSK9의 mRNA를 분해시키는 것이다. 이미 2008년에 PCSK9을 타깃팅하는 siRNA를 이용하여 동물모델에서 인간 PCSK9 유전자의 발현을 타게팅할 수 있다는 것을 보였다[5]. 알리남 파마슈티컬(Alynam Pharmaceutical)에서 2017년 NEJM에 보고한 인간 대상 1상 시험에 의하면 300mg 이상의 siRNA를 투여받은 시험군에서 PCSK9 단백질 수준은 84일간 74% 이내로 떨어졌으며, LDL 콜레스테롤 수준은 59.7% 이하로 떨어졌으며 약효는 1회 주사후 180일간 유지되었다[6].
한편 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, ASO)를 이용하여 PCSK9 의 mRNA를 분해시켜 PCSK9의 수준을 떨어뜨리는 전략 역시 시도되고 있다. ASO는 화학적으로 변형되어 투여시에 안정성을 유지할 수 있도록 만들어진 변형 뉴클레오타이드로써, 유인원 실험에서 PCSK9 수준을 85% 감소시키고, LDL 콜레스테롤 수준을 50% 감소시키는 좋은 결과를 냈다[7]. 그러나 산트리스 파마슈티컬(Santris Pharmaceutical)에서 진행한 인간 대상으로 한 첫번째 임상 1상 시험에서는 시험대상 환자 6명중 4명에서 신장독성이 나타나는 부작용에 나타나서 임상 1상 시험은 중단되었다.
즉, 항체에 의한 PCSK9의 저해가 이미 세포 밖으로 배출된 PCSK9를 억제한다면 RNAi/ASO에 의한 PCSK9의 발현 억제는 세포 내에서 새롭게 만들어지는 PCSK9을 억제한다는 개념으로서, 일부의 경우에는 지금 임상 단계이고, 일부의 경우에는 임상 1상에서의 부작용 때문에 현재 중지된 단계이다. 이러한 전략이 기존의 항체에 의한 PCSK9의 저해에 비해서 얼마나 유효할지의 여부가 판명되기 위해서는 더욱 많은 연구가 필요할 것으로 생각된다.
소분자물질에 의한 PCSK9의 억제는 가능할까?
항체 혹은 RNAi 등의 새로운 약물접근방식(modality)의 PCSK9 저해제의 경우 앞에서 이야기한 것처럼 생산원가 문제 때문에 가격이 높아질 수 밖에 없고, 이것은 거의 평생 투여받아야 하는 질환의 특성상 약물의 경제성에 큰 영향을 미친다. 결국 경제성이라는 관점에서 스타틴과 같은 소분자 물질에 의한 콜레스테롤 저해제와 비슷한 수준이 되기 위해서는 소분자 물질에 의한 PCSK9의 억제가 필요하다.
그러나 단백질-단백질 상호작용을 저해하는 소분자 화합물의 개발의 어려움을 잠시 이야기했지만 근본적으로 PCSK9의 활성을 저해하기 위해서는 PCSK9와 LDL 리셉터간의 결합을 억제해야 하는데, 단백질간 상호작용은 넓은 표면적에 의한 상호작용이기 때문에 소분자에 의해서 효과적으로 억제하기 힘들다.
이러한 근본적인 난점에도 불구하고 소분자 물질이 가지는 근본적인 약물로써의 장점 때문에 PCSK9의 활성을 억제하는 물질을 발굴하려는 노력은 계속되고 있다.
이러한 시도 중의 하나는 2016년 화이자(Pfizer)에서 발표한 한 논문에서 잘 나와 있다. 화이자는 PCSK9가 LDL 리셉터에 결합하기 위해서는 자체 단백질 분해효소 활성에 의해서 절단된 이후 세포 바깥으로 분비되어야 한다는 것에 착안하여 세포 수준에서 PCSK9를 분비를 억제하는 소분자 화합물을 표현형 스크리닝(Phenotype screening)을 통하여 탐색하였다. 화이저가 보유하고 있던 255만개의 화합물 중 PCSK9의 분비 수준을 감소하는 물질이 발굴되었고 이를 최적화한 결과 PF-06446846라는 물질이 탄생하였는데, 특이하게도 이 물질의 작용기전은 리보좀에 결합하여 PCSK9 mRNA의 단백질로의 번역(Translation)을 억제하는 것임이 밝혀졌다[8,9]. 특정한 mRNA의 번역을 특이적으로 억제하는 소분자물질은 기존에 보고되지 않은 매우 새로운 작용기전으로써, 기존에 모든 단백질에 공통적으로 적용되는 기전이라고 생각했던 전사/번역 기전 역시 약물의 타깃으로 이용할 수 있다는 것을 암시해주는 결과이다. 해당 후보화합물은 래트에서 PCSK9 수준과 LDL 콜레스테롤 수준을 낮추는 것은 확인되었으나 임상 개발로 이어질 수준의 효과는 아니었고, 동물실험에서 LDL 콜레스테롤을 낮추는 투여량에서는 혈액관련 세포수의 감소와 같은 부작용이 나타난다는 것이 발견되어 더이상 개발이 이어지지는 않았다. 이러한 결과는 특정 유전자의 단백질 번역 단계가 새로운 약물의 타깃으로 이용될 수 있다는 희망과 함께, 이러한 것이 실제 임상개발로 이어지기 위해서는 여러가지 난점을 극복해야 한다는 현실을 동시에 보여주는 셈이다.
이상으로 HMG 환원효소 외에 새로운 콜레스테롤 조절의 타깃으로 떠오르는 PCSK9를 제어하는 새로운 약물을 개발하려는 노력을 소개하였다. 특히 PCSK9는 기존의 HMG 환원효소와 같이 소분자물질로 비교적 쉽게 저해물질을 찾을 수 있는 효소가 아닌 단백질간 상호작용을 억제하여야만 하는 타깃임을 생각해 볼때, PCSK9를 대상으로 하는 유효한 억제 수단을 찾는 노력은 기존의 타깃에 비해서 좀 더 쉽지 않은 과제이며, 새로운 약물접근방식과 기존에 발견되지 않은 새로운 생물학적 기전의 탐구가 동시에 이루어져야 하는 과제임을 잘 보여주고 있다.
이상으로 지난 7회에 걸쳐 연재된 고콜레스테롤증을 제어하는 수단을 찾기 위한 연구의 역사에 대한 연재를 종료하고자 한다.한다. 다음 연재에서는 지금까지 다룬 것과는 다른, 새로운 분야의 혁신 신약의 개발의 역사를 알아보게 될 것이다.
참고문헌
1. Arkin, M. R., Tang, Y., & Wells, J. A. (2014). Small-molecule inhibitors of protein-protein interactions: progressing toward the reality. Chemistry & biology, 21(9), 1102-1114.
2. Sabatine, M. S., Giugliano, R. P., Wiviott, S. D., Raal, F. J., Blom, D. J., Robinson, J., ... & Scott, R. (2015). Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. New England Journal of Medicine, 372(16), 1500-1509.;Robinson, J. G., Farnier, M., Krempf, M., Bergeron, J., Luc, G., Averna, M., ... & Koren, M. J. (2015). Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. New England Journal of Medicine, 372(16), 1489-1499.
3. Sabatine, M. S., Giugliano, R. P., Keech, A. C., Honarpour, N., Wiviott, S. D., Murphy, S. A., ... & Sever, P. S. (2017). Evolocumab and clinical outcomes in patients with cardiovascular disease. New England Journal of Medicine, 376(18), 1713-1722.
4. Kazi, D. S., Moran, A. E., Coxson, P. G., Penko, J., Ollendorf, D. A., Pearson, S. D., ... & Bibbins-Domingo, K. (2016). Cost-effectiveness of PCSK9 inhibitor therapy in patients with heterozygous familial hypercholesterolemia or atherosclerotic cardiovascular disease. Jama, 316(7), 743-753.
5. Frank-Kamenetsky, M., Grefhorst, A., Anderson, N. N., Racie, T. S., Bramlage, B., Akinc, A., ... & Gamba-Vitalo, C. (2008). Therapeutic RNAi targeting PCSK9 acutely lowers plasma cholesterol in rodents and LDL cholesterol in nonhuman primates. Proceedings of the National Academy of Sciences, 105(33), 11915-11920.
6. Fitzgerald, K., White, S., Borodovsky, A., Bettencourt, B. R., Strahs, A., Clausen, V., ... & Fernando, C. (2017). A highly durable RNAi therapeutic inhibitor of PCSK9. New England Journal of Medicine, 376(1), 41-51.
7. Lindholm, M. W., Elmén, J., Fisker, N., Hansen, H. F., Persson, R., Møller, M. R., ... & Koch, T. (2012). PCSK9 LNA antisense oligonucleotides induce sustained reduction of LDL cholesterol in nonhuman primates. Molecular Therapy, 20(2), 376-381.
8. Petersen, D. N., Hawkins, J., Ruangsiriluk, W., Stevens, K. A., Maguire, B. A., O’Connell, T. N., ... & Hepworth, D. (2016). A small-molecule anti-secretagogue of PCSK9 targets the 80S ribosome to inhibit PCSK9 protein translation. Cell chemical biology, 23(11), 1362-1371.
9. Lintner, N. G., McClure, K. F., Petersen, D., Londregan, A. T., Piotrowski, D. W., Wei, L., ... & Geoghegan, K. F. (2017). Selective stalling of human translation through small-molecule engagement of the ribosome nascent chain. PLoS biology, 15(3), e2001882.







