기사본문
BMS 승부수, 'TMB 바이오마커' 전략에 회의론 배경은?
입력 2019-01-29 12:06 수정 2019-02-08 10:13
바이오스펙테이터 김성민 기자
BMS(Bristol-Myers Squibb)가 옵디보+여보이 병용투여로 비소세포폐암 1차 치료제 시장에 들어가는데 차질이 생겼다. BMS는 옵디보+여보이의 약물 반응성을 예측하는 바이오마커(predictive biomarker)로 종양변이부담(tumor mutational burden, TMB)을 기준으로 삼았다. 그러나 이같은 BMS 전략에 대해 업계에서 회의론이 일고 있다.
BMS는 지난 24일 지난해 4분기 실적을 발표하는 자리에서 미국 식품의약국(FDA)에 제출했던, 옵디보(니볼루맙)+여보이(이필리무맙)의 적응증 확대 허가신청(supplemental biologics license application, sBLA)을 철회한다고 밝혔다. sBLA 승인이 미뤄지고 있는 상황에서 BMS가 내린 결정이다. BMS은 같은 임상 데이터로 유럽 식품의약청(EMA)에서도 검토 절차를 밟고 있다.
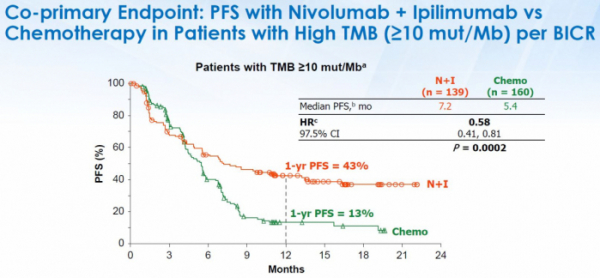
▲BMS AACR 2018 발표 자료
지난해 6월에 BMS는 FDA에 CheckMate-227 임상3상 결과를 바탕으로 sBLA 신청서를 제출했다. BMS는 CheckMate-227 임상 3상에서 약물을 투여한지 1년이 된 시점에서 TMB 고발현 환자(TMB≥10mut/Mb)를 대상으로 무진행생존기간(progression-free survival, PFS) 지표에서 여보이+옵디보를 병용투여하자 백금기반 화학치료법 대비 43% vs 13%(p=0.0002)라는 유의미한 결과를 확인했다고 발표했다. 또한 생존기간은 23.03개월인 반면 화학치료군은 16.72개월이었다(HR, 0.77; 95% CI, 0.56-1.06). BMS가 지난해 4월 미국암학회(AACR)에서 해당 데이터를 공개했었고, 업계는 새로운 바이오마커로 TBM가 가진 가능성을 긍정적으로 평가했다.
그러나 유럽 규제당국은 BMS에 TMB가 낮은 환자(TMB <10 mut/Mb)의 OS 데이터를 요구했고, BMS는 미국과 유럽 규제기관에 CheckMate-227 임상 3상의 파트1의 OS 분석 결과를 제출했다. TMB가 낮은 그룹에서 병용투여 그룹의 생존 기간은 16.20개월이었으며, 화학치료군은 12.42개월을 보였다(HR, 0.78; 95% CI, 0.61-1.00). TMB가 높은 경우 HR 값이 0.77이고, TMB가 낮은 경우 HR 값이 0.78로 동일한 것이 문제가 됐다. 이는 TMB가 생존기간을 예측하는 바이오마커로 역할을 하지 못한다는 것을 의미한다.... <계속>







