기사본문
AZ-다이이찌, 'HER2 ADC' 유방암 2상서 ‘ORR 60.9%’
입력 2019-12-13 07:09 수정 2019-12-17 07:28
바이오스펙테이터 서일 기자

아스트라제네카와 다이이찌산쿄의 HER2 ADC 치료제 'DS-8201'이 6번 이상 치료받은 HER2 양성 전이성 유방암환자에서 높은 반응률을 보이며 시장 출시 기대감을 높였다. 로슈의 HER2 ADC 치료제 '캐싸일라(Kadcyla®)'가 출시된 후 8년만이다.
아스트라제네카(AstraZeneca)와 다이이찌산쿄(Daiichi Sankyo)는 11일(현지시간) 2019 샌안토니오 유방암학회(2019 San Antonio Breast Cancer Symposium, SABCS)에서 HER2 양성 전이성 유방암 환자 대상으로 한 DS-8201(Trastzumab deruxtecan) 상업화 임상 2상에서 긍정적인 결과를 도출했다고 밝혔다. 이 결과는 같은 날 국제학술지 NEJM(New England Journal of Medicines)에도 게재됐다(DOI: 10.1056/NEJMoa1914510)
DS-8201은 아스트라제네카가 지난 3월 다이이찌산쿄에 총 69억달러를 주고 미국 등의 개발권과 판권을 확보한 약물이다. DS-8201은 HER2를 타깃하는 항체약물 접합체(antibody-drug conjugate, ADC)다. ADC는 암세포에서 발현하는 타깃에 결합하는 단일 클론 항체와 단일 클론 항체에 부착된 링커를 통해 화학독성치료제를 암세포에 전달하는 기전을 가진다. 로슈의 HER2 ADC 치료제 캐싸일라(Kadcyla®, Trastuzumab emtansine, T-DM1) 이후 8년만에 효능은 높이고 부작용은 줄인 2세대 HER2 ADC 치료제를 기대할 수 있게 됐다.
발표에 따르면 DS-8201(5.4mg/kg)은 전체 반응률(objective response rate, ORR) 60.9%를 보이며 1차 종결점을 충족시켰다(95% CI: 53.4-68). 이번 임상 2상은 기존에 6개 치료제로 치료받은 적이 있고, 적어도 두 가지 이상의 HER2 타깃 치료요법을 받은 경험이 있는 HER2 양성 전이성 환자 184명을 대상으로 임상을 진행했다.
추가로, DS-8201 임상은 HER2 양성 전이성 유방암 환자에서 97.3% 질병통제율(disease control rate, DCR)을 보이며 긍정적이었다. DCR은 완전관해(complete response rate, CR), 부분 반응(partial response, PR), 질병 안정율(stable disease)를 합친 수치다. DS-8201을 투여받은 환자에서 CR은 6%, PR은 54.9%, SD는 36.4%를 보였다. DS-8201로 치료받은 환자의 반응 지속시간(duration of response, DoR) 중간값은 14.8개월(95% CI: 93.8-99.1), 무진행 생존기간(progression-free survival, PFS) 중간값은 16.4개월(95% CI: 12-NE)을 보였다. 전체 생존기간(overall survival, OS) 중간값은 아직 도출되지 않았지만 1년 시점에서 86%(95% CI: 80-91) 환자가 생존할 것으로 추정된다고 전했다.
DS-8201의 안전성과 내약성 프로파일은 기존 임상에서 보인 결과와 일치했다. 가장 흔한 3등급 이상 작용은 호중구 수 감소(20.7%), 빈혈(8.7%), 구역(7.6%) 등이다. 환자 13.6%에서 치료와 관련된 폐질환(interstitial lung disease)이 보였다.
이번 상업화 임상 2상은 기존에 치료받은 6개 치료제에 대한 중간값(range, 2-27)을 가지고있고, 적어도 두 가지 이상의 HER2 타깃 치료요법을 받은 경험이 있는 HER2 양성 전이성 환자 184명을 대상으로 진행됐다. 임상에 참여한 환자가 받은 기존 치료요법 비율은 캐싸일라 100%, 트라스트주맙 100%, 전신요법 99.5%, 퍼투주맙(pertuzumab) 65.8%, 다른 HER2 항체 치료제 54.3%, 호르몬 요법 48.9%였다.
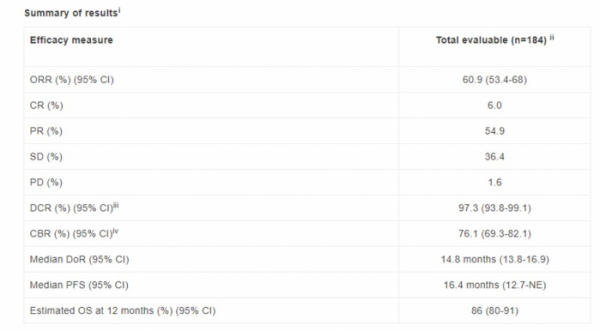
▲DS-8201 임상 2상 결과 요약(아스트라제네카 홈페이지 참조)
호세 바셀가(Jose Baselga) 아스트라제네카 종양학 연구부 부사장은 “환자들이 보여준 유의미하고 지속적인 약물 반응은 HER2 양성 전이성 유방암에 대한 새로운 치료제로 DS-8201의 가능성을 보여준다”며 “여러 선행 치료법을 받은 환자들 대상으로 한 인상적인 결과”라고 말했다.
안토니 위버(Antonie Yver) 다이찌산쿄 종양학 연구개발 부사장은 “이 특별하게 조작된 HER2 표적화 항체 약물 접합체(ADC)는 HER2 양성 전이성 유방암 환자에게 더 좋은 효과를 보였다”고 전했다.
한편, 지난 10월 아스트라제네카와 다이이찌산쿄가 제출한 DS-8201의 신약허가신청서는 미국 식품의약국(FDA)의 우선심사(priority review) 대상으로 지정됐다. 처방의약품 신청자 수수료법(PDUFA)에 따라 2020년 2분기에는 승인여부가 결정될 예정이다.





![[인사]유한양행, 2026년 1월 임원 인사](https://img.etoday.co.kr/crop/268/200/2044634.jpg)

