기사본문
오토텍바이오, 핵심 플랫폼 ‘AUTOTAC’ "논문 게재"
입력 2022-03-18 10:13 수정 2022-03-18 10:49
바이오스펙테이터 김성민 기자

▲doi: 10.1038/s41467-022-28520-4
오토텍바이오(AUTOTAC Bio)가 자체 개발한 자가포식(autophagy) 매개 ‘AUTOTAC(AUTOphagy-TArgeting Chimera)’ 이중결합(bifunctional) 약물이 새로운 표적단백질분해(TPD) 플랫폼으로서 개발 가능성을 보여주는 연구결과를 발표했다.
오토텍바이오는 AUTOTAC이 자가포식수용체 p62를 통해 타깃을 분해하는 작용 메커니즘과 현재 TPD 방식으로는 타깃하기 어려운 신경퇴행성질환과 종양단백질을 분해하는 연구결과를 최근 네이처 커뮤니케이션(Nature Communications, IF: 14.919)에 게재했다고 17일 밝혔다.
TPD는 기존의 저분자화합물 기반 저해제가 타깃하지 못하는 80%의 단백질에 대한 표적 가능성을 넓혀주는 신규 모달리티(modality)로 주목받고 있는 분야다. 현재의 TPD 기술은 아비나스(Arvina)의 'PROTAC' 기술과 같이 체내 분해경로 중 하나인 유비퀴틴(ubiquitination)에 초점이 맞춰져 있다. 다만 약물표적이 종양단백질과 같이 짧은 반감기를 가지는 유비퀴틴화 기질로 제한된다는 단점도 있다. 또한 유비퀴틴 의존적인 방식은 최종적으로 표적단백질을 분해하는 프로테아좀(proteasome)의 사이즈 제한 때문에 퇴행성뇌질환에서 두드러지는 잘못접힌(misfolded) 단백질이나 병리 응집체 등은 타깃하기가 어렵다는 것이 한계다.
이에 따라 최근 오토파지-리소좀(lysosome) 경로를 매개로 하는 분해약물이나 몰레큘러글루(molecular glue) 기술인 AUTAC, ATTEC, LYTAC 등이 등장하고 있다.
오토텍바이오는 이러한 기술과 비교해 AUTOTAC이 차별화 포인트를 갖는다고 본다. 논문에 따르면 LYTAC(Lysosome-targeting chimaeras)은 세포밖 단백질을 타깃하는 기술이며, ATTEC(autophagosome-targeting compounds)은 표적단백질을 오토파지 경로에서 표적을 먼저 격리하는(sequestration) 과정없이 변이 헌팅턴단백질(mutant Htt)이나 지질방울(lipid droplet)을 오토파고좀(autophagosome)으로 바로 타깃한다.
또한 히로카즈 아리모토(Hirokazu Arimoto) 교수팀의 AUTAC(Autophagy-targeting chimera) 기술은 S-구아닐화(S-guanylation) 경로를 이용하기 때문에 여전히 표적단백질의 유비퀴틴화에 의존적이라고 설명했다. 오토텍바이오는 유비퀴틴화와 프로테아좀에 비의존적이며 더 넓은 단백질에 적용할 수 있는 TPD 기술을 개발했다.
선택적 거대오토파지(selective macroautophagy) 경로는 세포질내 단백질, 응집체, 소기관 등을 먼저 격리(sequestered)를 통해 비활성화해, 오토파고좀으로 전달하고 이후 리소좀에서 분해하는 경로이다. 오토텍바이오는 이러한 작용을 매개하는 수용체 중 하나인 p62를 이용하며, 회사에 따르면 아직까지 p62 등 오토파지 수용체를 직접 타깃해 이를 격리하는 표적단백질분해 기술은 없다.
오토텍바이오의 AUTOTAC 플랫폼은 크게 2가지 파트로 구성된다. p62에 결합하는 ATL(autophagy-targeting ligand) 파트와 표적단백질에 결합하는 TBL(target-binding ligands) 파트다. 오토텍바이오는 p62의 ZZ도메인에 결합하는 리간드(Nt-Arg)를 모사하는 ATL를 제작했으며, ATL 파트가 p62의 구조를 특정 도메인(PB1, LIR)이 노출되는 활성화 상태로 바꾸면서, p62가 자가중합(self-polymerization) 복합체를 이루면서, 잇따라 TBL에 결합한 표적단백질 격리와 분해를 유도하는 컨셉이다.
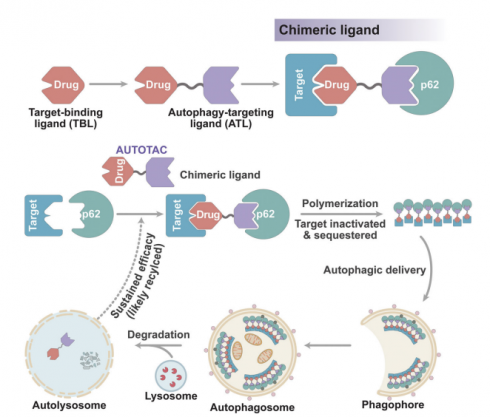
▲AUTOTAC 작용 메커니즘
이번 네이처 커뮤니케이션에 게재된 논문에서는 AUTOTAC이 p62를 매개로 표적단백질을 분해하는 메커니즘을 증명한 결과가 발표됐다. 연구팀은 AUTOTAC을 실제 표적단백질에 적용한 연구에서 단량체(monomer)의 여러 종양단백질(oncoprotein) 뿐만 아니라 기존에는 분해하기 어려웠던 퇴행성뇌질환 응집체까지 분해하는 것을 확인했다. 향후 약물개발 플랫폼으로서 가능성을 보여주는 연구결과다.
구체적으로 연구팀은 인비트로 암세포주에서 AUTOTAC이 종양관련 단백질 ER, AR, MetAP2 등 표적을 p62 매개로 분해했으며 하위신호전달 과정을 불활성화시키는 효과를 확인했다.
다음으로 유비퀴틴화된 잘못접힌 단백질 응집체(Ub-conjugated misfolded protein aggregates)를 분해할 수 있는지 테스트했다. 보통 용해성(soluble)의 잘못접힌 단백질은 유비퀴틴-프로테오좀 시스템(UPS)을 통해 잘리지만, 프로테아좀의 크기 제한으로 올리고머나 응집체가 잘리지 못하는 경우도 있다. 이에 AUTOTAC으로 UPS에 저항성을 가지는 병원성 응집체를 타깃할 수 있는지 평가했다.
오토텍바이오는 응집체에 결합하는 FDA 승인화합물의 리간드를 이용해 테스트한 결과 오토파지-리소좀 경로를 통해 응집체를 억제한 결과를 관찰했다. 또한 퇴행성뇌질환이나 다른 단백질병증(proteinopathy)에 대해서도 테스트하기 위해 미국 FDA 승인약물 중 올리고머~응집체 결합하는 특성을 가진 리간드(4-phenylbutyric acid, PBA)를 AUTOTAC에 적용했을 때도 변이형 타우단백질, 변이형 헌팅턴 단백질 등을 분해하는 것을 확인했다.
마지막으로 오토텍바이오는 인비보 시험으로 타우병증을 가진 알츠하이머병 모델에서도 응집체 결합 PBA 리간드를 적용한 AUTOTAC이 뇌조직내 타우 응집체를 분해했다.







