기사본문
FDA, 혈액암 PI3K 저해제 ‘코픽트라’ “사망위험 경고”
입력 2022-07-04 07:06 수정 2022-07-04 07:06
바이오스펙테이터 서윤석 기자

미국 식품의약국(FDA)은 지난달 30일 세큐라바이오(Secura Bio)의 혈액암 치료제 ‘코픽트라(Copiktra, duvelisib)’에 대해 사망위험과 심각한 부작용 증가 가능성(possible increased risk of death and serious side effects)을 경고했다고 밝혔다.
FDA는 "심각한 부작용, 용량조절 및 이러한 부작용으로 인한 사망비율도 코픽트라를 투여받은 환자에서 더 높았다"며 “의료진은 이번 데이터를 환자와 논의하고 최선의 조치를 진행하길 권한다”고 말했다.
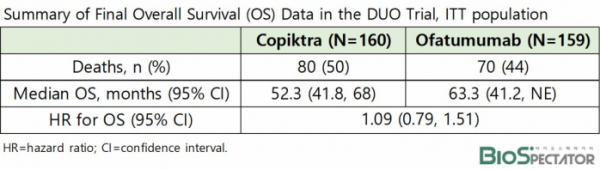
PI3Kδ/γ 저해제 코픽트라는 지난 2018년 만성 림프구성백혈병(CLL), 소림프구성림프종(SLL) 적응증으로 정식승인 받았다. FDA는 승인기반이 된 임상 3상(NCT02004522)의 63개월(중앙값) 추적관찰 결과 코픽트라 투여군에서 사망위험 및 심각한 부작용 증가 가능성을 확인했다(HR 1.09).
임상 추적관찰에서 코픽트라를 투여받은 환자 80명(80/160명)이, 대조약물인 노바티스의 ‘아제라(Arzerra, Kesimpta, ofatumumab)’는 70명(170/159명)이 사망했으며, 감염, 설사, 장·폐의 염증, 피부반응, 간 효소 상승 등 심각한 부작용 발생빈도도 코픽트라 투여군에서 더 높았다.
한편 FDA 항암제 자문위(ODAC)는 지난 4월 단일군(single arm) 임상을 기반으로 가속승인받은 PI3K 저해제가 시판 후 임상에서 효능과 안전성을 입증하지 못해 철회되면서, 앞으로는 대조군과 비교한 데이터를 필요성을 강조했다.
세큐라는 코픽트라를 단일군 임상결과를 기반으로 여포성림프종(FL)에 대해 가속승인받았으나 시판 후 임상을 진행하지 못하면서 해당 적응증에 대해서는 승인을 철회한 바 있다.
(FDA 자료참조)







