기사본문
DBV, '땅콩 알레르기 패치' 치료제 FDA “승인 거절”
입력 2020-08-06 07:27 수정 2020-08-06 08:30
바이오스펙테이터 서윤석 기자

프랑스 바이오텍 DBV 테크놀러지스(DBV Technologies)가 땅콩알레르기 패치의 미국 식품의약국(FDA) 승인에 실패했다. FDA는 패치의 접착 부위 변경과 이에 따른 추가 임상결과와 패치의 제조 및 공정에 대한 결과를 요구하는 최종보완요구(CRL)를 DBV에 보냈다.
현재 땅콩 알레르기 치료제로 승인 받은 약물은 에이뮨의 '팔포지아'가 유일하다.
DBV는 4일(현지시간) 4~11세 어린이의 땅콩 알레르기를 치료하기 위한 '비아스킨(Viaskin peanut, DBV712)' 패치에 대해서 미국 식품의약국(FDA)의 승인을 받는데 실패했다고 밝혔다. 이 소식이 알려진 후 DBV의 주가는 전일 종가대비 37.61% 하락해 마감했다.
비아스킨은 하루에 한번 피부에 붙이는 패치 제형으로 땅콩 알레르기 항원을 지속적으로 피부에 노출시켜 면역반응을 낮추는 방식의 치료제다. 접착부위와 피부사이에 미세한 공간이 있어 피부에서 자연증발하는 수분에 의해 약물이 녹아나와 알레르기 유발 항원에 노출되는 기전이다.
FDA는 약물 효능에 중점을 둔 패치의 접착 부위(adhesion site) 변형(modification)이 필요하며, 이에 따른 새로운 임상결과를 요구하는 최종보완요구(CRL) 공문을 DVB에 보냈다. 추가로 화작(Chemistry), 제조(Manufacturing), 제어 데이터(Controls data)도 요구했다. 그러나 안전성에 대한 문제를 제기하지는 않았다.
Daniel Tasse DBV CEO는 “FDA의 반응에 실망했으나 비아스킨의 잠재력을 믿고 있다”며 “FDA와 완전히 협력해 문제를 해결하도록 노력할 것”이라고 말했다.
한편, 경쟁약물인 에이뮨의 땅콩 알레르기 치료제 ‘팔포지아(Palforzia, AR101)’는 지난 3월 FDA의 승인을 받아 출시되면서 첫 땅콩 알레르기 치료제가 됐다. 에이뮨은 2분기 보고서에서 팔포지아 매출이 57만5천달러였다고 밝혔다.
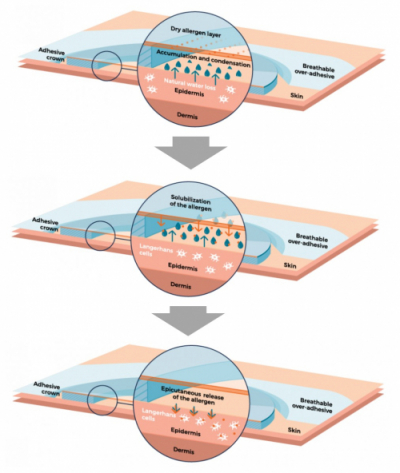
▲비아스킨 패치 작동기전(DBV 홈페이지 참조)







