기사본문
'반전의 성공' 세레스, 마이크로바이옴 신약 '3가지 시사점'
입력 2020-10-08 10:45 수정 2020-10-08 11:15
바이오스펙테이터 김성민 기자
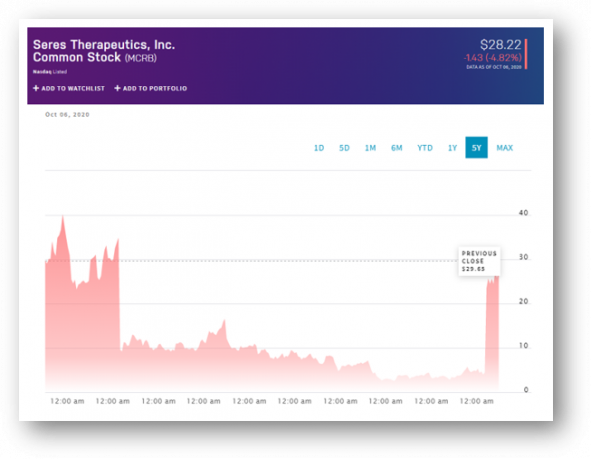
▲나스닥에서 세레스 테라퓨틱스의 지난 5년간 주가변화(2020.10.06 기준)
마이크로바이옴(microbiome) 신약 개발 분야가 전환점을 맞고 있다. 올해 8월 세레스 테라퓨틱스(Seres Therapeutics)가 '마이크로바이옴 신약의 첫 임상3상 성공'이라는 결과가 나오면서, 마이크로바이옴 치료제가 시판될 것이라는 기대감을 불어 넣었다. 이 소식에 회사 주가는 389% 급등하면서 회사의 시가총액은 2조원에 이르렀다. 2020년 10월 5일 기준 나스닥에 상장한 마이크로바이옴 회사 가운데 가장 큰 규모다. 이제 업계의 시선은 미국 식품의약국(FDA)이 첫 마이크로바이옴 신약 시판을 허가할 것인가에 집중되고 있다.
특히 이번 임상 결과가 더 파급력을 가졌던 이유는, ‘예상치 못한 성공’이라는 측면때문이다. 세레스는 최초로 마이크로바이옴 치료제의 임상3상 성공이라는 타이틀을 거머쥐기 전까지 지난 4년 동안 우여곡절 과정을 겪었다.
SER-109은 앞서 임상에서 실패했던 약물이다. 2016년 7월 세레스는 SER-109 임상2상에서 위약군 대비 CDI(Clostridium difficile infection) 감염 위험을 낮추지 못했고, 세레스가 임상 실패를 발표하고 당일 주가는 70% 폭락했다. SER-109는 CDI 파이프라인으로 가장 앞서가는 후보물질이자 세레스는 나스닥에 첫 상장한 회사(당시 1억3400만달러 공모금 유치)라는 점에서 업계는 이 상황을 민감하게 받아드릴 수밖에 없었다. 업계 전반에 걸쳐 마이크로바이옴 치료제에 대한 기대감이 위축되는데 중대한 영향을 미쳤다.
그럼에도 세레스는 쉽게 물러서지 않았다. 회사는 긍정적인 결과를 발표했던 임상1b상과 임상2상의 임상 프로토콜, 환자 선정, 각 임상에 참여한 환자 특성, 약물 제조과정, 안전성과 효능 등에 대한 전반적인 측면을 검토해 실패 원인을 분석했다. 이어 2017년 미국 식품의약국(FDA)과 논의해 SER-109의 개발 전략을 수정해 임상3상에 재도전했다.... <계속>







